企业档案
会员类型:会员

已获得易推广信誉 等级评定
(0 -40)基础信誉积累,可浏览访问
(41-90)良好信誉积累,可接洽商谈
(91+ )优质信誉积累,可持续信赖
易推广会员:8年
最后认证时间:
注册号: 【已认证】
法人代表: 【已认证】
企业类型:生产商 【已认证】
注册资金:人民币万 【已认证】
产品数:91228
参观次数:11305709
技术文章
mTOR 通路是如何调控自噬的?
点击次数:448 发布时间:2021/6/29 13:07:37
自噬一直是研究中的热门话题,而 mTOR 通路是信号通路中的“明星”,两者之间“剪不断理还乱”,这个故事还要从“调控”说起……
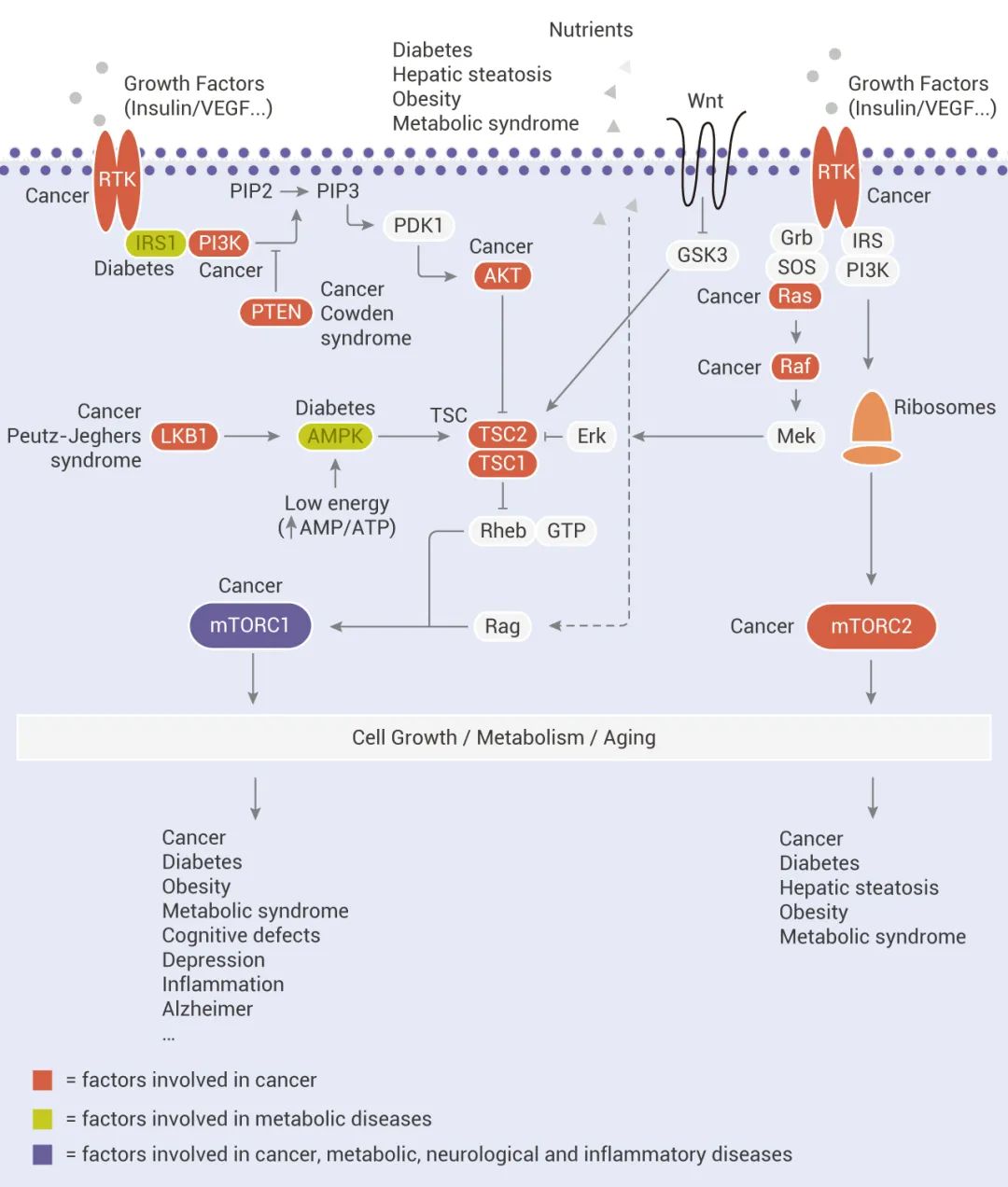
mTOR 是细胞生长和代谢的主要调节分子,可促进合成代谢过程,如核糖体的生物发生 (Ribosome biogenesis) 以及蛋白质、核苷酸、脂肪酸和脂质的合成,并抑制分解代谢过程,如自噬。mTOR 信号的失调与许多人类疾病有关,包括糖尿病、神经退行性疾病和癌症。
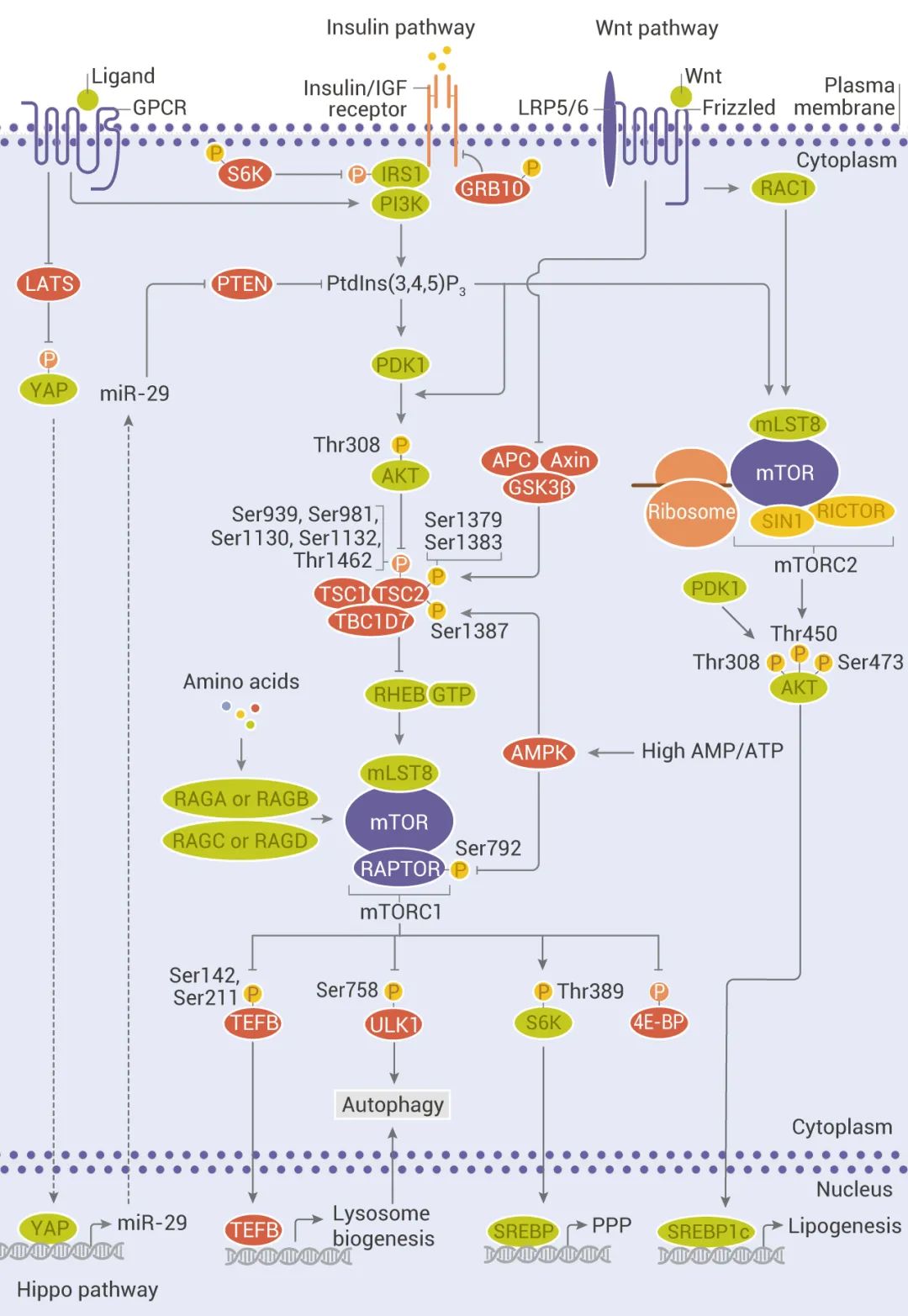
mTOR 是一种丝氨酸/苏氨酸激酶,属于 PI3K 相关激酶 (PIKK) 家族的成员,可与几种蛋白质相互作用形成两个不同的复合物,分别称为 mTOR 复合物 1 (mTORC1) 和 2 (mTORC2)。mTORC1 包含 mTOR、Raptor、PRAS40、mLST8 和 DEPTOR,对雷帕霉素 (Rapamycin) 敏感;mTORC2 包含 mTOR、Rictor、SIN1、Protor-1、mLST8 和 DEPTOR,对雷帕霉素急性治疗不敏感。
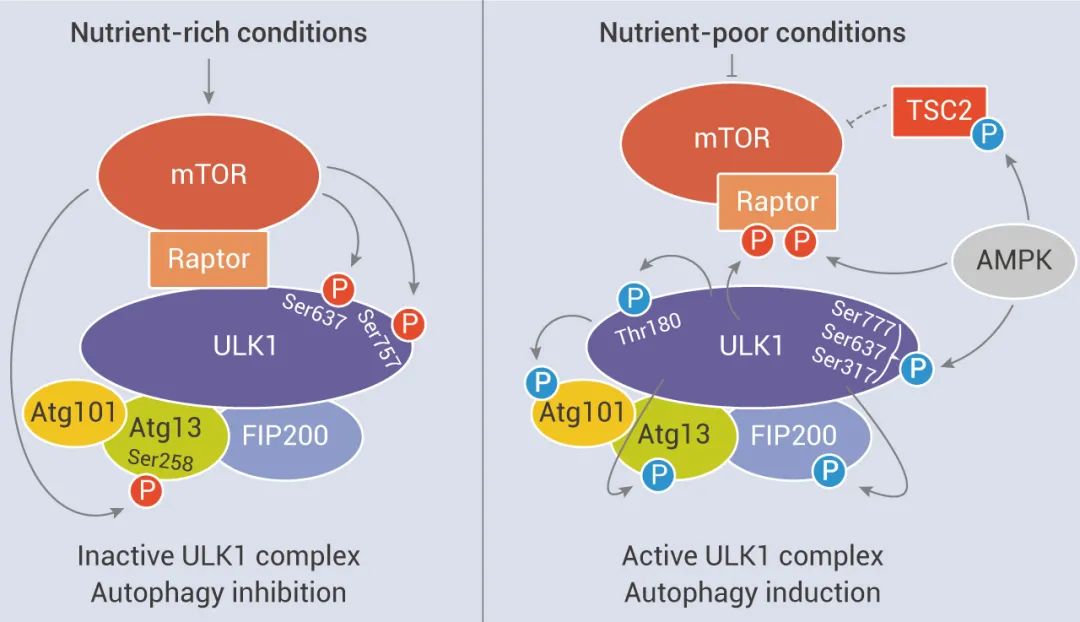
mTOR 通过与 mTORC1 或 mTORC2 的关键组分如 Raptor、Rictor、LST8 和 SIN1 作用,催化多个靶标的磷酸化,如 S6K1、4E-BP1、Akt、PKC、 IGF-IR 和 ULK1,从而调节蛋白合成、营养代谢、生长因子信号传导、细胞生长和迁移以及调节自噬等。
1、生长因子和激素 (例如胰岛素) 通过 I 类 PI3K 及其下游效应子 AKT 的激活来调节 mTORC1 信号传导,从而逆转 TSC1/TSC2 复合物和 PRAS40 对 mTORC1 信号传导的抑制作用;
2、营养物质如氨基酸通过促进 RAS 相关 GTP 结合蛋白 (RAG) 异二聚体向活性构象的转化来刺激 mTORC1;
图 2. mTOR 上游:经典和非经典输入[1]
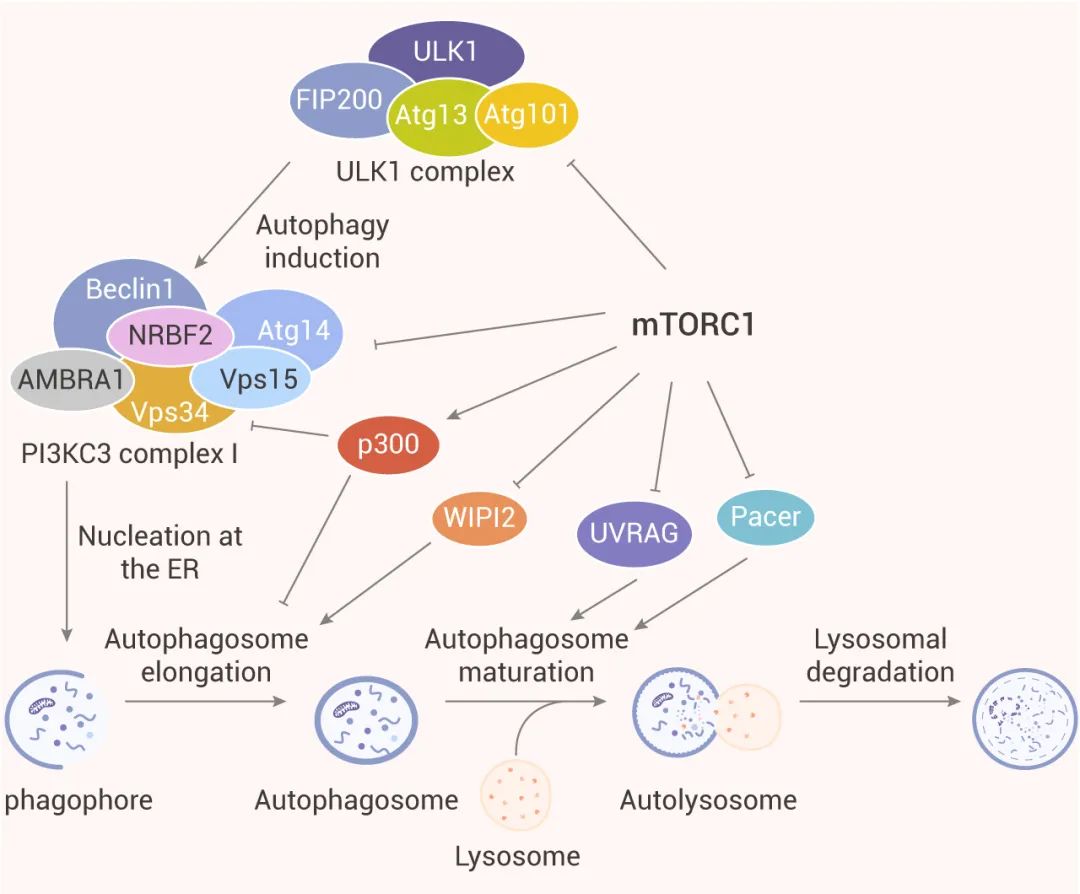
图 3. mTORC1 对自噬各个步骤的调控[9]
3、自噬的成核步骤受到 PI3KC3 复合体 I 中 Atg14、AMBRA1 和 NRBF2 的磷酸化抑制。因此,mTORC1 可以通过磷酸化其成分 Atg14,AMBRA1 和 NRBF2 直接调节 PI3KC3-CI 的活性。
4、研究表明,mTORC1 通过分别靶向 WIPI2 和 p300 乙酰转移酶参与调节自噬体形成的延伸步骤,以及 LC3 与自噬体膜的结合。如通过抑制 p300 分子内自抑制,可促进 LC3 的乙酰化,这阻碍了 LC3 的脂化。WIPI2 通过与 Atg16L 结合并将 Atg12-Atg5-Atg16L 复合物结合到吞噬细胞上来促进磷脂酰乙醇胺对 LC3 的脂化作用。
5、mTORC1 还可以通过调节溶酶体生物发生所需基因的转录来间接抑制自噬。如 TFEB 是溶酶体生物发生和自噬基因的主要转录调节因子。TFEB 可上调与自噬体形成、自噬体与溶酶体的融合相关,以及溶酶体生物发生所需的一系列基因。此外,TFEB 的过表达可增加 UVRAG、WIPI、MAPLC3B、SQSTM1、VPS11、VPS19 和 ATG9B 的表达,它们参与了自噬的各个步骤。此外,mTORC2 也可通过激活 mTORC1 间接抑制自噬。
由于自噬与运动、代谢适应和衰老等生理过程,以及神经退行性疾病、传染病、心血管疾病,癌症等疾病过程有关,但自噬诱导是利是弊,取决于疾病的类型或阶段。例如,当营养有限时,自噬可以通过向肿瘤细胞提供营养来促进肿瘤发生和发展。因此,自噬的抑制可能使癌细胞对代谢应激条件敏感,从而导致细胞死亡。另外,mTORC1 作为自噬的主要调节剂,参与自噬过程,是极具有潜力靶标,实际上,mTORC1 的失调已经牵涉到与自噬缺陷相关的疾病中,并且已经有 mTOR 抑制剂在临床试验中或获批用于治疗这些疾病。
总之,mTOR 促进合成代谢并抑制自噬诱导,而用 mTOR 抑制剂调节自噬为多种疾病提供了新的治疗策略。
| 具有诱导自噬作用的 mTOR 抑制剂 |
| |
| |
| |
| |
| |
MCE 的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务
参考文献
↓ 下滑查看更多文献
1. Shimobayashi M, et al. Making new contacts: the mTOR network in metabolism and signalling crosstalk. Nat Rev Mol Cell Biol. 2014; 15(3): 155-162.
2. Dazert E, et al. mTOR signaling in disease. Curr Opin Cell Biol. 2011; 23(6): 744-755.
3. Hua H, et al. Targeting mTOR for cancer therapy. J Hematol Oncol. 2019; 12(1): 71. Published 2019 Jul 5.
4. Mossmann D, et al. mTOR signalling and cellular metabolism are mutual determinants in cancer. Nat Rev Cancer. 2018; 18(12): 744-757.
5. Alayev A, et al. mTOR signaling for biological control and cancer. J Cell Physiol. 2013; 228(8): 1658-1664.
6. Kim J, et al. AMPK and mTOR regulate autophagy through direct phosphorylation of ULK1. Nat Cell Biol. 2011; 13(2): 132-141.
7. Wang H, et al. The Upstream Pathway of mTOR-Mediated Autophagy in Liver Diseases. Cells. 2019; 8(12): 1597.
8. Kim YC, et al. mTOR: a pharmacologic target for autophagy regulation. J Clin Invest. 2015; 125(1): 25-32.
9. Akpedje S. Dossou, et al. The Emerging Roles of mTORC1 in Macromanaging Autophagy. Cancers (Basel). 2019 Oct; 11(10): 1422.
10. Paquette M, et al. mTOR Pathways in Cancer and Autophagy. Cancers (Basel). 2018; 10(1): 18.
11. Laplante M, et al. mTOR signaling in growth control and disease. Cell. 2012; 149(2): 274-293.