企业档案
会员类型:会员

已获得易推广信誉 等级评定
(0 -40)基础信誉积累,可浏览访问
(41-90)良好信誉积累,可接洽商谈
(91+ )优质信誉积累,可持续信赖
易推广会员:8年
最后认证时间:
注册号: 【已认证】
法人代表: 【已认证】
企业类型:生产商 【已认证】
注册资金:人民币万 【已认证】
产品数:91228
参观次数:11306183
技术文章
且看 ATM 激酶活化变单体后的神奇开挂!
点击次数:686 发布时间:2021/6/29 14:26:55
ATM (Ataxia-telangiectasia mutated proteins) 是一种丝氨酸-苏氨酸蛋白激酶,是 DNA 损伤应答 (DDR) 的关键调节因子。ATM 是位名副其实的“指挥官”,在 DNA 双链断裂 (DSB) 中,参与细胞周期检查点维护、DNA 损伤修复和端粒维护等,在调节细胞对 DNA 损伤的反应中发挥重要作用。ATM 的激活在阻碍肿瘤发生、代谢综合症和神经退行性疾病中起重要作用。
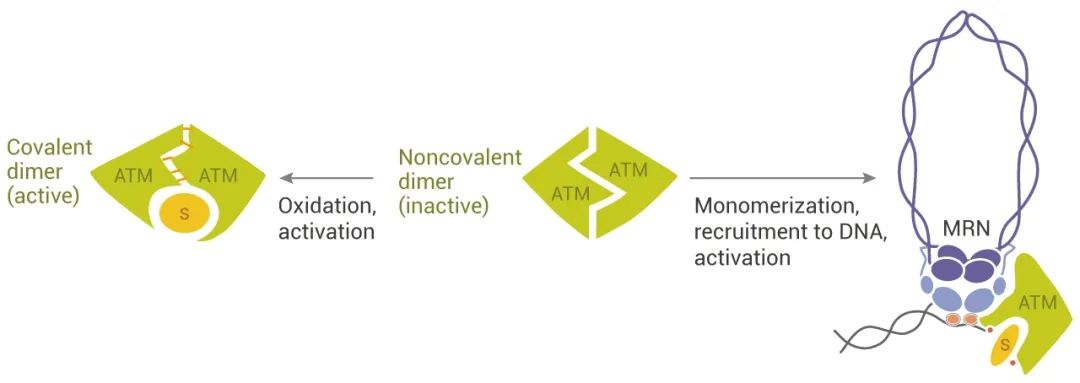
图 1. ATM 的激活[3]
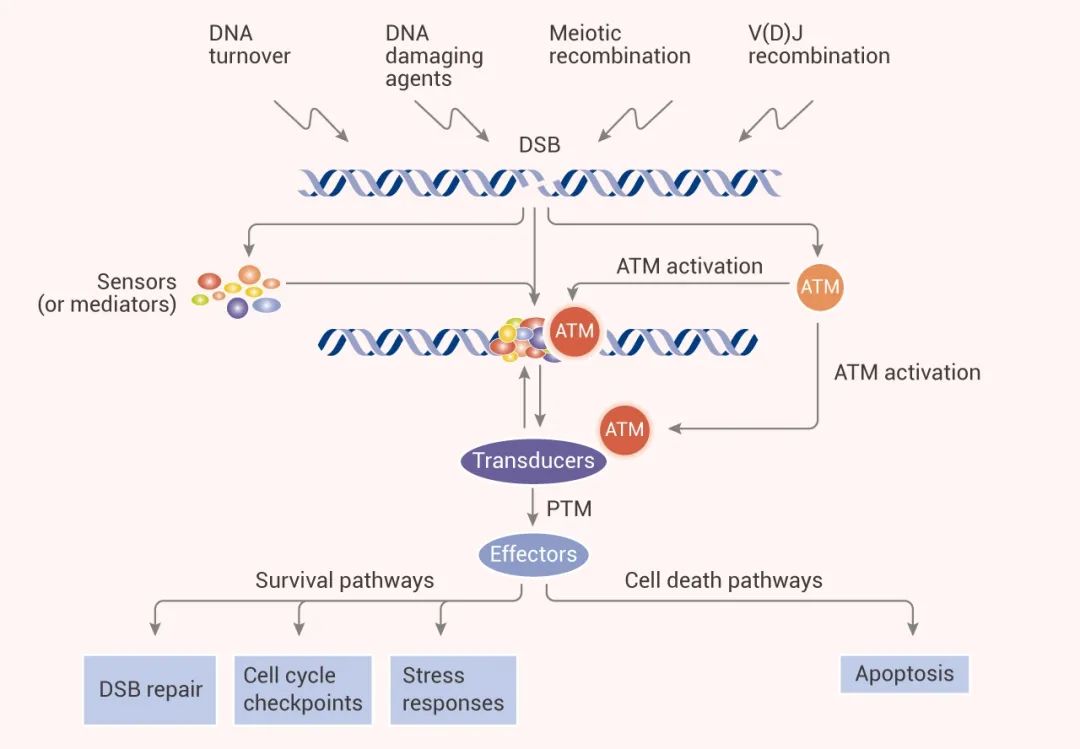
ATM 是 DSB 反应的主调节器,被 MRN 复合物都激活后,原本静止的 ATM 变成一个“贪婪”的磷酸化机器。ATM 能磷酸化 700 多个底物蛋白上的丝氨酸/苏氨酸-谷氨酰胺基序 (S/T-Q motifs)。ATM 通过磷酸化下游多种蛋白,包括 p53、Chk2、BRCA1、 RPAp34、H2AX、SMC1、FANCD2、Rad17、Artemis 和 Nbs1 等,启动信号级联,参与细胞周期检查点控制、凋亡反应和 DNA 修复等。
图 2. DDR 级联反应和 ATM[7]
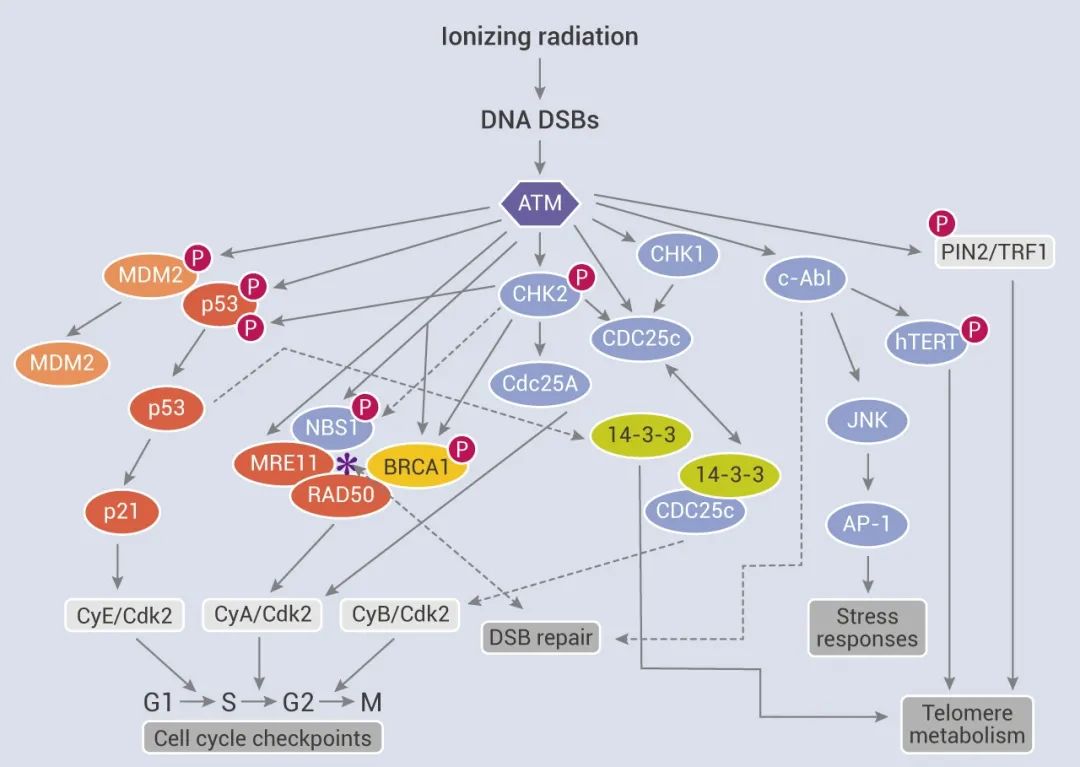
被激活的 ATM 也磷酸化了 MRE11-RAD50-NBS1-BRCA1 复合体中的 NBS1,这条途径诱导了 S 期阻滞。此外,被 ATM 磷酸化并激活后的 CHK2 也可能通过磷酸化 BRCA1 或 NBS1 参与该通路。S 期检查点的调节很复杂,涉及多种途径。
图 3. ATM 在细胞周期检查点中的作用[5]
| 相关化合物 |
| 有用的 ATM/ATR 抑制剂,用于癌症研究。 |
| 口服可利用的,可穿透血脑屏障的 ATM 抑制剂,IC50 <6.2 nM。在细胞中抑制 ATM,IC50 为 0.31 μM。 |
| 可逆的 ATM 抑制剂,IC50 值为 4.1 μM,对 PI3K,PIKKs 家族其他蛋白没有作用。 |
| 抑制 ATM 磷酸化和 DNA 修复。 |
| Cell Counting Kit-8,简称CCK-8试剂盒或CCK8试剂盒,是一种基于WST-8而广泛应用于细胞活性和细胞毒性检测的快速、高灵敏度试剂盒。 |
A-T: Ataxia-telangiectasia
DSB: Doublestrand breaks
PTMs: Post-translational modifications
DDR: DNA damage response
ATR: Ataxia telangiectasia and Rad3-related
DNA-PKcs: DNA-dependent protein kinase catalytic subunit
PIKKs: Phosphatidylinositol (PI) 3-kinase-like kinases
↓ 下滑查看更多文献
1. J-H Lee, et al. Activation and regulation of ATM kinase activity in response to DNA double-strand breaks. Oncogene. 2007 Dec 10;26(56):7741-8.
2. Mei Hua Jin, et al. A repair in cancer. Pharmacol Ther. 2019 Nov; 203: 107391.
3. Tanya T Paull. Mechanisms of ATM Activation. Annu Rev Biochem. 2015;84:711-38.
4. Andrew N Blackford, et al. ATM, ATR, and DNA-PK: The Trinity at the Heart of the DNA Damage Response. Mol Cell. 2017 Jun 15;66(6):801-817.
5. Kastan, M. B., et al. THE MANY SUBSTRATES AND FUNCTIONS OF ATM. Nature Reviews Molecular Cell Biology. 2000. 1(3), 179-186.
6. K K Khanna, et al. ATM, a central controller of cellular responses to DNA damage. Cell Death Differ. 2001 Nov;8(11):1052-65.
7. Shiloh, Y., et al. The ATM protein kinase: regulating the cellular response to genotoxic stress, and more. Nature Reviews Molecular Cell Biology. 2013. 14(4), 197-210.
8. Yosef Shiloh, et al. The ATM-mediated DNA-damage response: taking shape. Trends Biochem Sci. 2006 Jul;31(7):402-10.
9. Anika Maria Weber, et al. Targeting ATM pathway for therapeutic intervention in cancer.Pharmacol Ther. 2015 May;149:124-38.