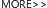企业档案
会员类型:会员

已获得易推广信誉 等级评定
171成长值
(0 -40)基础信誉积累,可浏览访问
(41-90)良好信誉积累,可接洽商谈
(91+ )优质信誉积累,可持续信赖
易推广会员:8年
最后认证时间:
注册号: 【已认证】
法人代表: 【已认证】
企业类型:生产商 【已认证】
注册资金:人民币万 【已认证】
产品数:91228
参观次数:11304684
技术文章
靶向抗体偶联药物 (ADC)——抗肿瘤 | MedChemExpress
点击次数:429 发布时间:2021/9/6 10:42:42
ADC 药物
20 世纪初,德国诺贝尔奖得主 Paul Ehrlich *早提出 ADC 药物的构思。1958 年,Mathe 将甲氨蝶呤偶联抗鼠免疫球蛋白治疗白血病,拉开了 ADC 药物的研究序幕。经过科学家们的不懈努力,ADC 药物终于取得突破性进展。特别是在实体瘤上的成功应用,ADC 药物的研发进入了黄金时代。根据 Nature 预测,未来 5 年 ADC 药物的全球市场销售额将会超过 164 亿美元。值得一提的是,我国自主研发的 ADC 药物维迪西妥单抗于 2021 年 6 月 9 日获 NMPA 批准上市。ADC 药物发展简史,以及已被 FDA 批准的部分 ADC 药物的结构图分别如下所示:
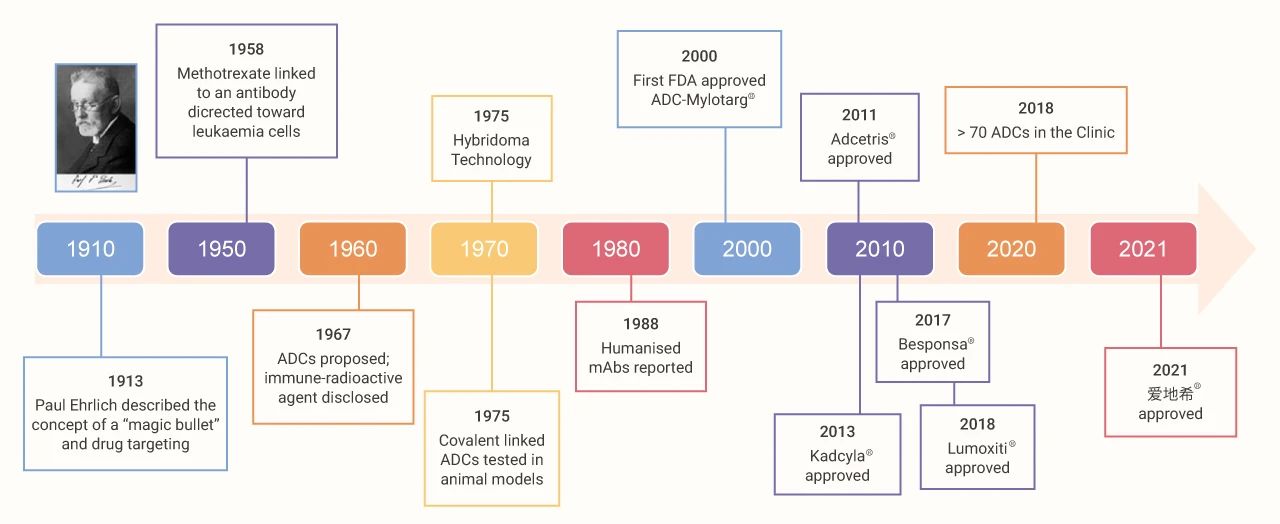
图 1. ADC 药物的发展史[2]
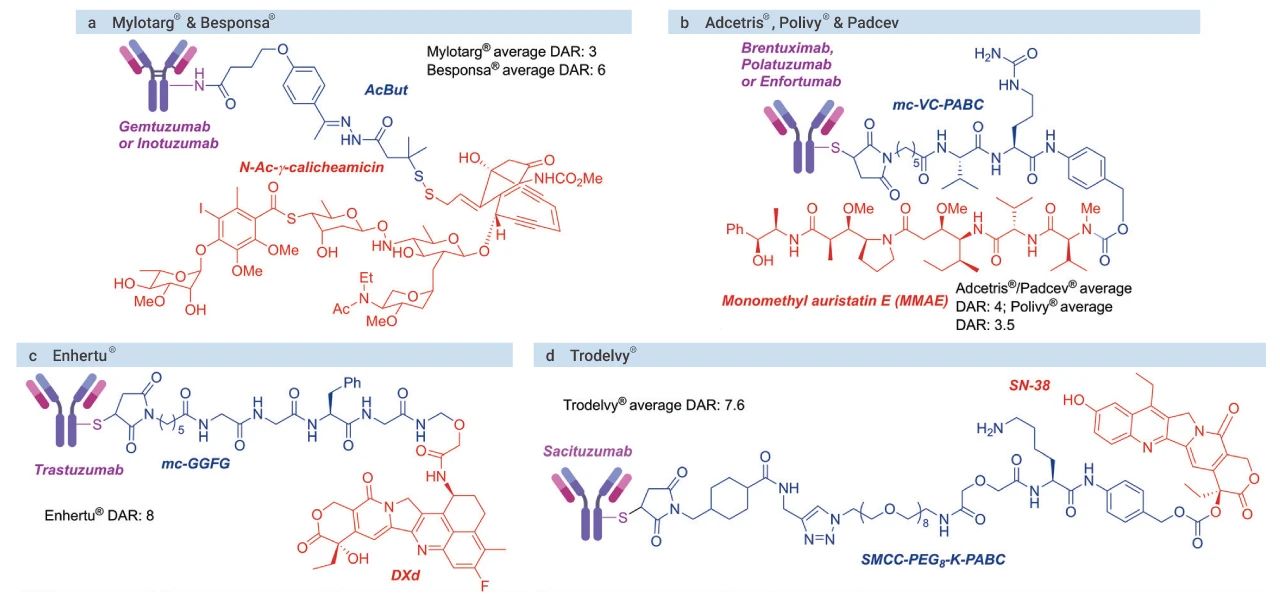
图 2. ADC 药物的结构[3]
(红色表示细胞毒素,蓝色表示连接子,其余表示抗体部分)
(红色表示细胞毒素,蓝色表示连接子,其余表示抗体部分)
ADC 药物的具体作用机制及其治疗窗
与传统的细胞毒性药物相比,ADC 药物可以增加有效载荷的效力,并降低其毒性。ADC 药物结合肿瘤相关抗原;进而通过内吞作用内化进入细胞;ADC 药物在溶酶体中发生裂解;之后有效载荷释放,并发挥药效 (破坏微管或者 DNA)并诱导靶细胞发生调亡[4]。细胞毒性药物的靶向递送,可以增加药物到达肿瘤细胞的百分比,从而降低了*小有效剂量,提高了耐受剂量。然而,由于脱靶毒性 (如连接子稳定性较差) 的存在,第二代 ADC 药物的治疗窗还是较窄 (图 3)。
抗体、连接子、有效载荷和偶联技术的不断优化,使得第三代 ADC 药物的治疗窗进一步增大,这也是目前的研究热点。
图 3. ADC 药物的治疗窗[5]
肿瘤靶抗原
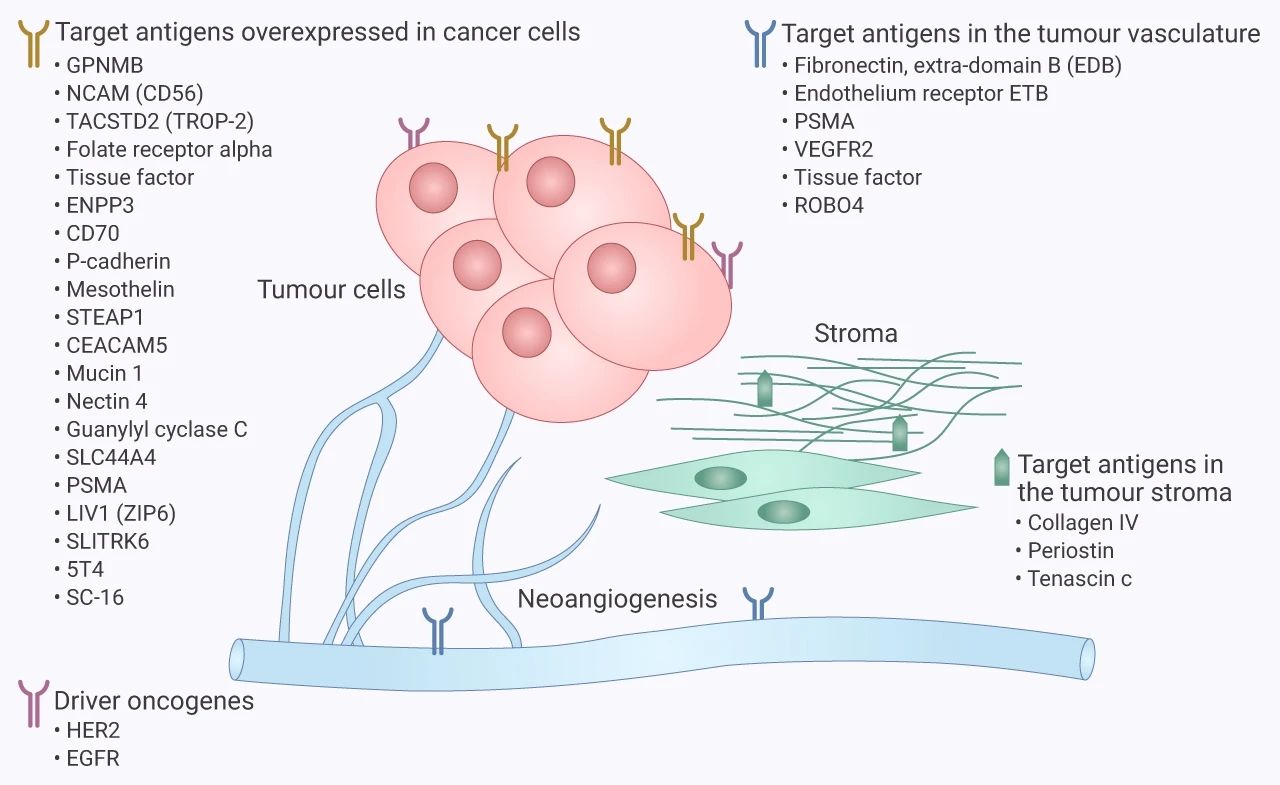
图 4. 实体瘤中 ADC 相关的靶抗原[6]
抗体
理想的抗体需要对肿瘤相关抗原具有较高的特异性和亲和力,血浆中稳定性好,免疫原性低,较低的交叉反应,较长的循环半衰期和有效的内化等特点。目前,所有临床和临床前发展的 ADCs 都含有免疫球蛋白 G (IgG) 同种型的抗体。IgGs 可分为四个亚型:IgG1、IgG2、IgG3 和 IgG4 (如图 5)。其中,IgG1 和 IgG4 被成功应用于 ADC 药物。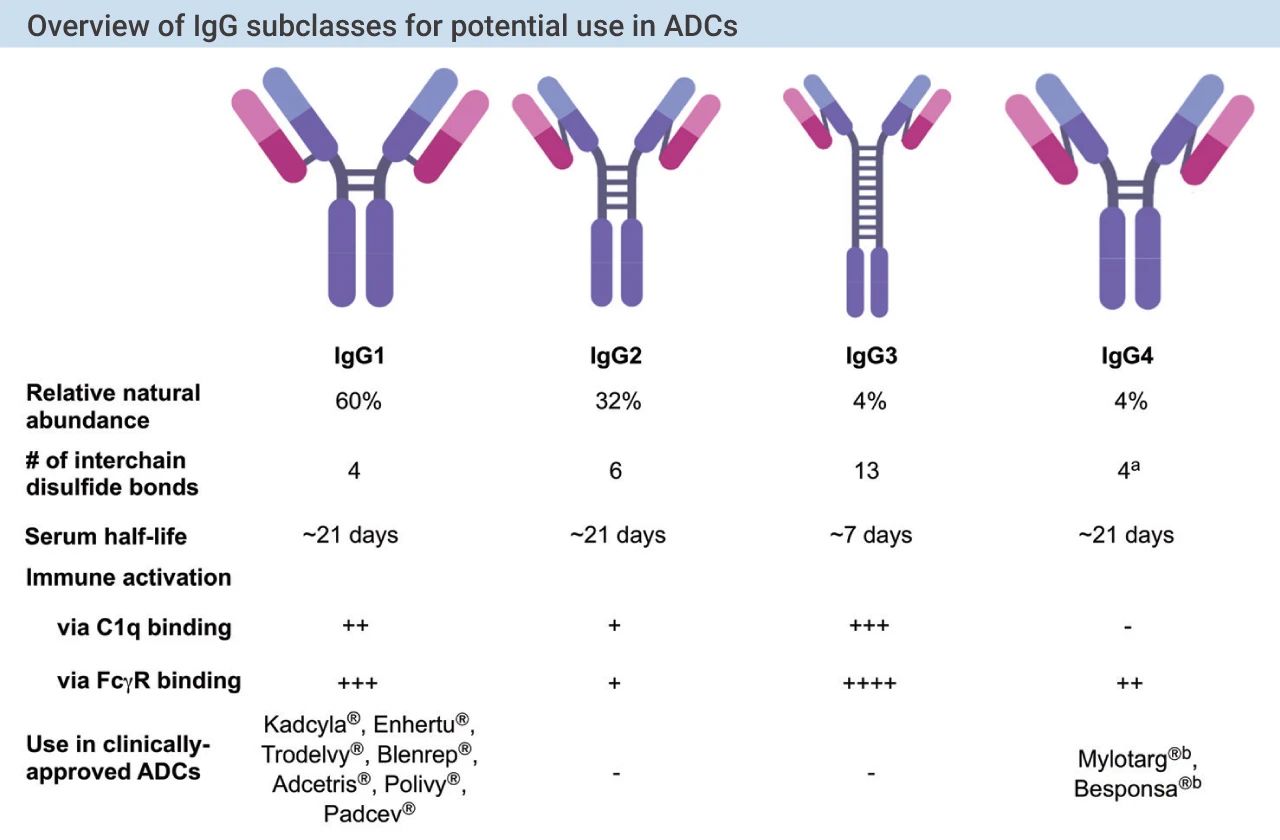
图 5. 用于 ADC 药物的 IgG 亚型总结[3]
有效载荷
理想情况下,它们对肿瘤细胞具有较高的毒性,IC50 值应在亚纳摩尔 (sub-nanomolar) 范围内 (如图 7)。此外,它们应具有合理的溶解度、足够的稳定性、较低的免疫原性和较长的半衰期。目前*常用的 Payloads 有:微管抑制剂 (如 MMAF)、DNA 损伤药物 (如卡奇霉素) 和其他的细胞毒性化合物 (如紫杉醇) (如图 6)。

图 6. ADC 药物的有效载荷[7]
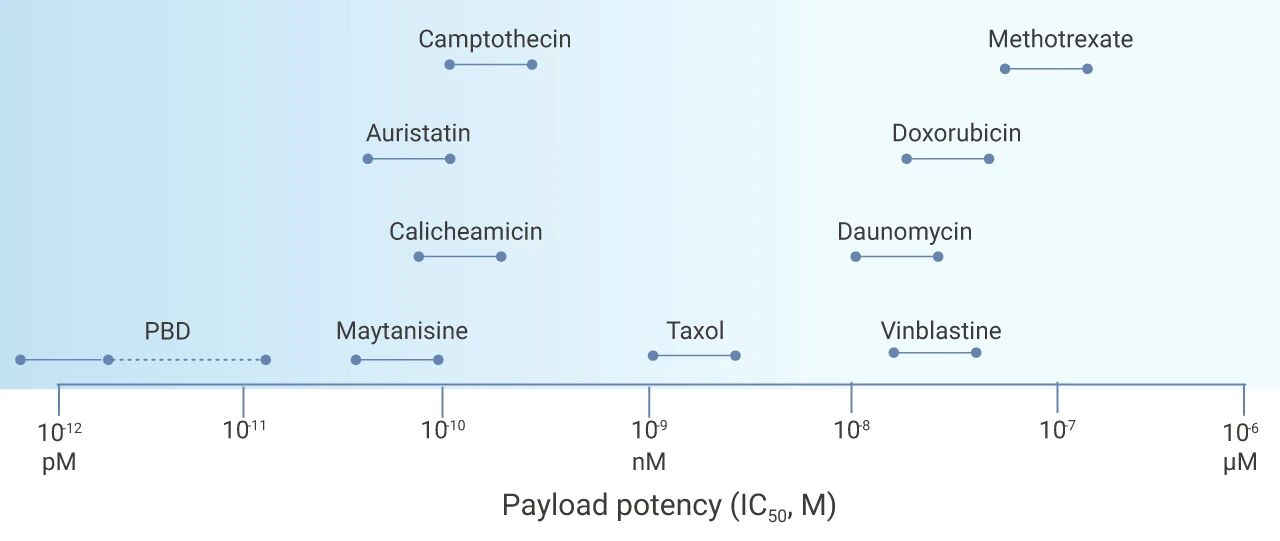
图 7. ADC 药物的有效载荷效力[8]
连接子
理想的连接子应在血液循环中十分稳定,以避免小分子毒素提前释放损伤正常的组织或细胞。同时,在肿瘤细胞内需能快速且有效地释放有效载荷。连接子主要有两种类型:可裂解型 (cleavable) 和不可裂解型 (non-cleavable)。可裂解型的连接子又可以分为:酸可裂解的、可还原的和蛋白酶可裂解的。

图 8. ADC 药物的连接子优缺点[9]
常见的可裂解型连接子有:腙类 (如 NH2-PEG4-hydrazone-DBCO)、二硫化物 (如 PDdEC-NB) 和二肽 (如 Boc-Dap-NE) 等;常见的不可裂解型连接子有:MC 和 SMCC 等。
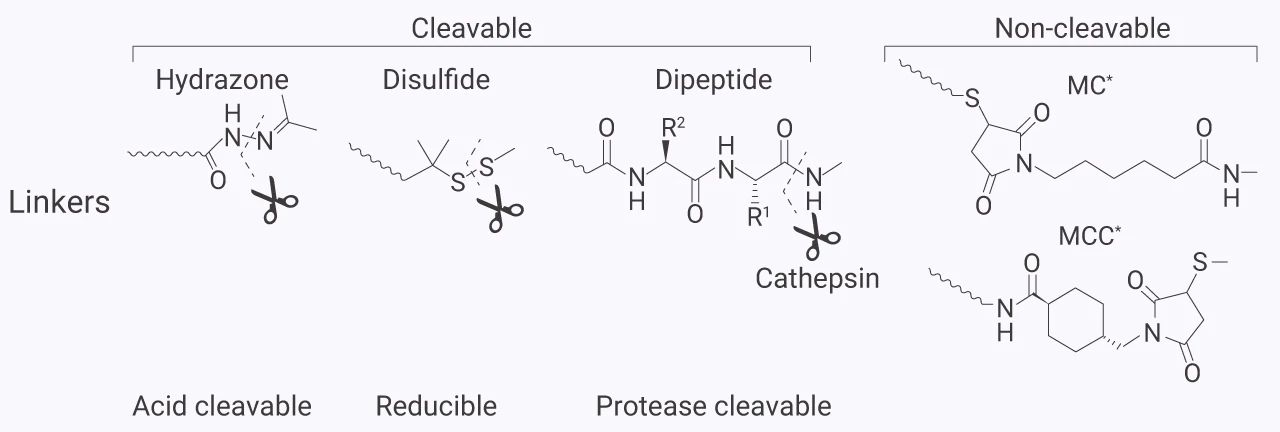
图 9. ADC 药物的连接子[7]
偶联技术
早期,FDA 批准的 ADC 药物大多采用异质化连接技术:即基于胺的赖氨酸连接 (amine-based lysine conjugation) 和基于巯基的半胱氨酸连接 (thiol-based cysteine conjugation) 等。然而,采用这些随机的连接策略,产生异质性和不稳定的 ADC 药物,带来更多的毒性风险 (如图 10)。
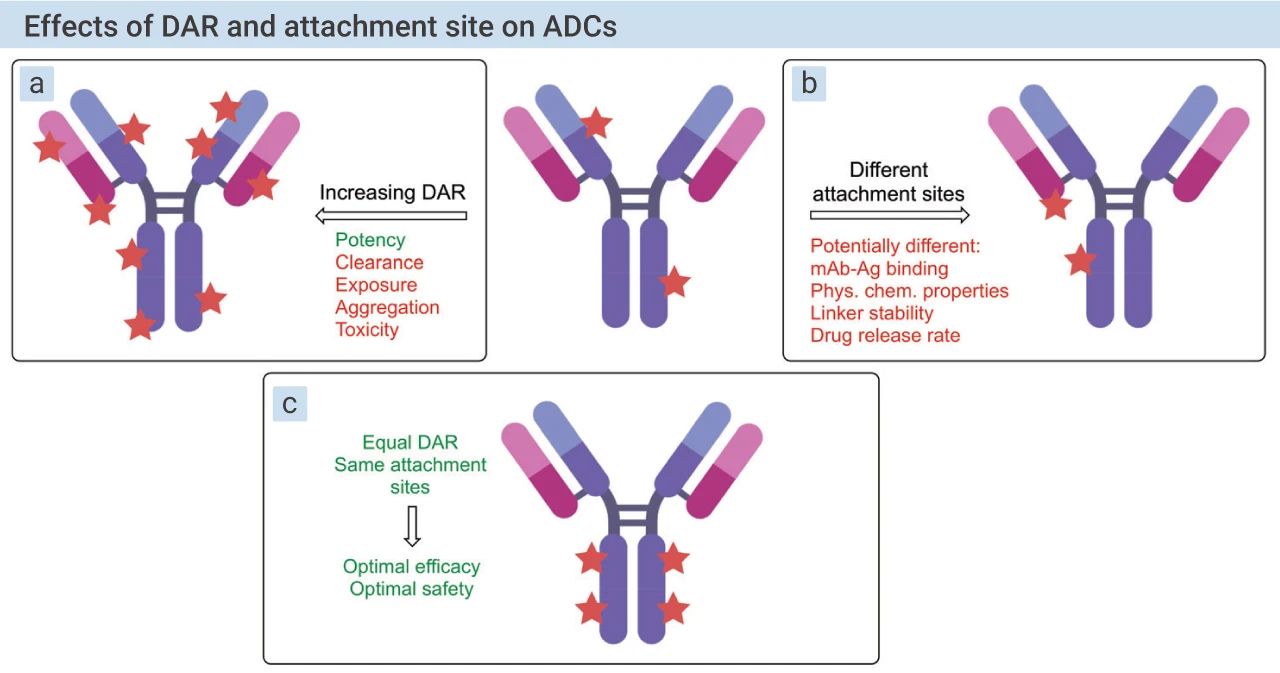
图 10. DAR 和连接位点对 ADC 药物的影响[3]
达到好的疗效和安全性,能产生同质性和稳定性 ADC 药物的连接技术成为研究热点。随着技术的不断更新,位点特异性连接 (site-specific conjugation) 技术可以产生同质的 ADC 药物,进一步增加治疗窗。这些可控的连接策略主要包括:Thiomab 定点偶联、非天然氨基酸定点偶联和各种酶催化的定点偶联等。
总结:
ADC 作为一种新型靶向的抗癌药物,拥有巨大的市场前景和发展空间。尽管 ADC 药物在抗肿瘤方面也有毒性风险,但随着工程化抗体的发展、连接子不断的优化、高活性载荷的发掘和偶联技术的不断完善,新型低毒的 ADC 药物将会不断涌现,我们相信,ADC 药物在未来 10 年将引领抗肿瘤新药研发。
MCE 的服务优势
■ 丰富的产品种类
服务全球 ADC 的研发与生产,拥有 900+ 的 ADC 相关产品,戳下图,见更多产品。
■ 强大的合成能力与经验
MCE 配备强大的技术人才团队和设备,对于 ADC 产品,我们拥有丰富的研发和生产经验,并与 Abbvie 和 AstraZeneca 等知名药企建立合作关系。
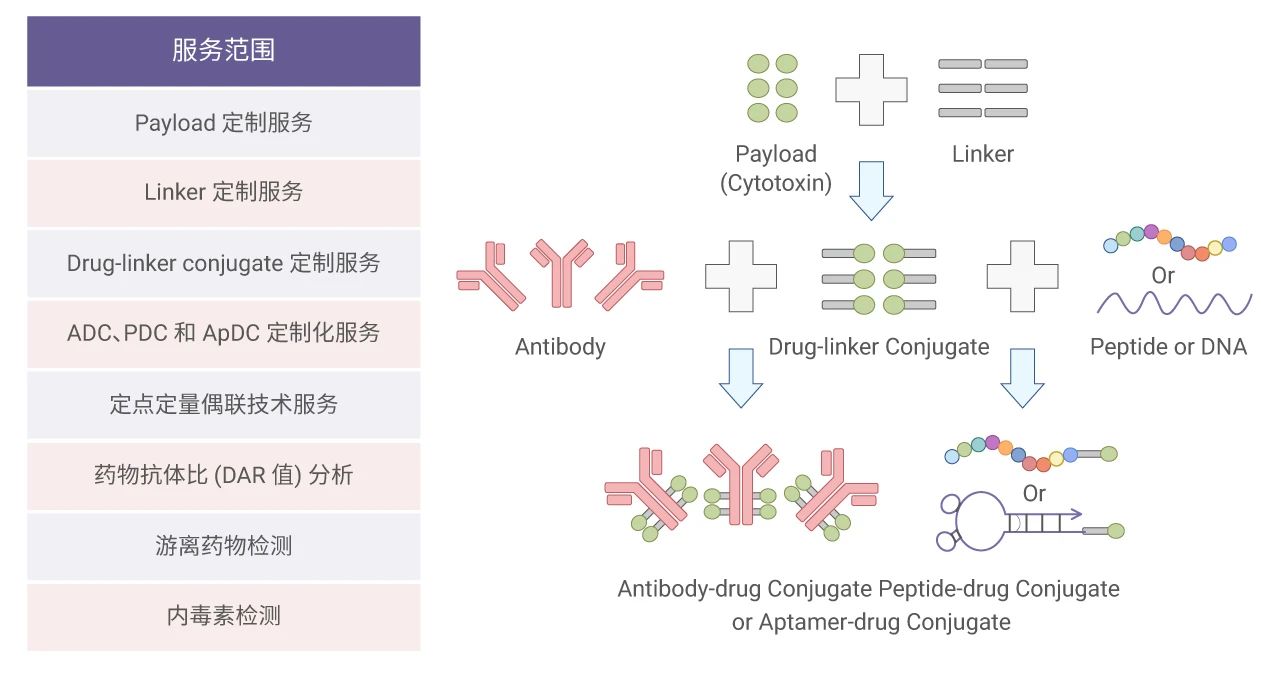
根据客户要求合成不同类型的 ADC 产品,确保产品的有效性与一致性,始终拥有好的服务品质。MCE 能够提供 ADC 相关产品的设计、合成、分析、纯化、优化、检测和评估等一站式服务。
相关服务
| ADC Cytotoxin |
| Mertansine (DM1) 是一种微管蛋白抑制剂,可以通过连接子偶联到单克隆抗体上,形成抗体偶联药物 (ADC)。 |
| Calicheamicin 是一种肿瘤抗生素,也是有效的细胞毒性试剂,可引起 DNA 双链断裂,抑制 DNA 合成。 |
| ADC Linker |
| MC-Val-Cit-PAB 是一种蛋白酶裂解的连接子,可用于制备 ADC 药物。 |
| SMCC 是一种不可裂解的连接子,可用于合成 ADC 药物。 |
| Drug-Linker Conjugates for ADC |
| SMCC-DM1 (DM1-SMCC) 是由连接子 SMCC 和毒性分子 DM1 连接而成的,可用来制备抗体偶联药物 (ADC)。 |
| MC-Val-Cit-PAB-duocarmycin 是抗体偶联药物的一部分,由 DNA 小沟结合烷化剂 duocarmycin 和 ADC 连接子 MC-Val-Cit-PAB 连接而成。 |
| Antibody-drug Conjugate (ADC) |
| Trastuzumab emtansine 是一种抗体偶联药物 (ADC),其结合了 HER2 靶向的曲妥珠单抗的抗肿瘤特性以及微管抑制剂 DM1 的细胞毒活性。可用于晚期乳腺癌的研究。 |
| Trastuzumab deruxtecan 是一种抗人表皮生长因子受体 2 (HER2) 抗体-药物偶联物 (ADC)。由人源化抗 HER2 抗体,酶促裂解的肽接头和拓扑异构酶 I 抑制剂组成。可用于 HER2 阳性乳腺癌和胃癌的研究。 |
参考文献
1. do Pazo C, Nawaz K, Webster RM, et al. The oncology market for antibody-drug conjugates. Nat Rev Drug Discov. 2021 Aug;20(8):583-584.
2. David E Thurston, Paul J M Jackson, et al. Cytotoxic Payloads for Antibody–Drug Conjugates[M]. The Royal Society of Chemistry, 2019.
3. Walsh SJ, Bargh JD, Dannheim FM, Hanby AR, Seki H, Counsell AJ, Ou X, Fowler E, Ashman N, Takada Y, Isidro-Llobet A, Parker JS, Carroll JS, Spring DR. Site-selective modification strategies in antibody-drug conjugates. Chem Soc Rev. 2021 Jan 21;50(2):1305-1353.
4. Chau CH, Steeg PS, Figg WD, et al. Antibody-drug conjugates for cancer. Lancet. 2019 Aug 31;394(10200):793-804.
5. Beck A, Goetsch L, Dumontet C, Corvaïa N, et al. Strategies and challenges for the next generation of antibody-drug conjugates. Nat Rev Drug Discov. 2017 May;16(5):315-337.
6. Diamantis N, Banerji U, et al. Antibody-drug conjugates--an emerging class of cancer treatment. Br J Cancer. 2016 Feb 16;114(4):362-7.
7. Drago JZ, Modi S, Chandarlapaty S, et al. Unlocking the potential of antibody-drug conjugates for cancer therapy. Nat Rev Clin Oncol. 2021 Jun;18(6):327-344.
8. Nakada T, Sugihara K, Jikoh T, Abe Y, Agatsuma T, et al. The Latest Research and Development into the Antibody-Drug Conjugate, [fam-] Trastuzumab Deruxtecan (DS-8201a), for HER2 Cancer Therapy. Chem Pharm Bull (Tokyo). 2019;67(3):173-185.
9. Tsuchikama K, An Z, et al. Antibody-drug conjugates: recent advances in conjugation and linker chemistries. Protein Cell. 2018 Jan;9(1):33-46