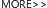企业档案
会员类型:会员

已获得易推广信誉 等级评定
171成长值
(0 -40)基础信誉积累,可浏览访问
(41-90)良好信誉积累,可接洽商谈
(91+ )优质信誉积累,可持续信赖
易推广会员:8年
最后认证时间:
注册号: 【已认证】
法人代表: 【已认证】
企业类型:生产商 【已认证】
注册资金:人民币万 【已认证】
产品数:91228
参观次数:11304932
技术文章
蛋白激酶/磷酸酶 调控信号通路、细胞机制 | MedChemExpress
点击次数:385 发布时间:2021/9/13 15:52:38
在蛋白激酶/磷酸酶被发现的初期,人们并没有意识到蛋白激酶/磷酸酶与疾病之间的广泛关联性。
1978 年,致癌基因劳斯氏肉瘤病毒 (Rous sarcoma virus, v-Src) 的转化因子被证实是一种蛋白激酶。1981 年发现 PKC 可以被促进肿瘤发生的佛波酯 (PMA) 激活。这些发现证明了蛋白质磷酸化在疾病发生中的重要作用,也拉开了以蛋白激酶/磷酸酶为靶点的药物开发的序幕。
磷酸化
蛋白磷酸化是一种调节众多细胞生理过程的翻译后修饰方式,调控细胞内多种信号通路。蛋白质磷酸化是一个可逆的动态过程,受到蛋白激酶 (protein kinases) 和磷酸酶 (phosphatases) 的竞争活性调节。磷酸化和去磷酸化常常是激活关键调控蛋白和控制信号通路传导的开关。一旦磷酸化过程发生异常,相关信号通路会出现功能失调。因此,蛋白质磷酸化的异常与多种类疾病的发生存在关联性,从癌症到炎症性疾病、糖尿病、传染病、心血管疾病等。目前,大量的蛋白激酶和磷酸酶已经成为了药物开发的热门靶点。
图 1. 磷酸化和去磷酸化过程[1]
蛋白激酶
蛋白激酶水解三磷酸腺苷 (ATP) 并将 ATP 末端磷酸基团 (PO4) 转移到多种氨基酸残基的羟基上,从而将蛋白质从疏水性修饰为亲水性,磷酸化的氨基酸可与其他蛋白质相互作用,进而对蛋白复合物进行组装和去组装。
在真核生物中,磷酸化作用主要发生在丝氨酸、苏氨酸和酪氨酸残基上。大多数激酶同时作用于丝氨酸和苏氨酸 (称为丝氨酸/苏氨酸激酶,protein serine/threonine kinases,PSKs)。PSKs 种类较多,包括蛋白激酶 A (protein kinase A, PKA),蛋白激酶 C (protein kinase C, PKC),钙/钙调素依赖性蛋白激酶 (Calcium/calmodulin dependent protein kinase, CaMK),G 蛋白偶联受体激酶,cGMP 依赖性蛋白激酶等。相对而言,作用于酪氨酸残基的酪氨酸激酶 (Protein tyrosine kinases, PTKs) 比较少见,PTKs 以表皮生长因子受体 (epidermal growth factor receptor, EGFR) 家族为典型代表。在原核生物中,*常见的磷酸化残基则是组氨酸和天冬氨酸。
蛋白激酶具有相似的三维催化结构域。这个催化结构域由 250~300 个氨基酸组成,包括 2 个亚结构域,N 端和 C 端。N 端和 C 端通过肽支架连接,两者之间形成一个深的凹槽,可以与肽底物和一个 ATP 分子结合。此外,蛋白激酶还具有非催化结构域,允许底物的附着和其他信号蛋白的募集。

图 2. 蛋白激酶 A 催化亚基结构示意图[2]
N 端为淡蓝色,C 端为红色,肽底物为黄色,ATP 为橙色。
N 端为淡蓝色,C 端为红色,肽底物为黄色,ATP 为橙色。
蛋白激酶磷酸化可能触发构象的转换,导致蛋白的激活或失活。由磷酸化引起构象变化的一个经典例子是糖原磷酸化酶。糖原磷酸化酶非活化状态和活化状态的转变由一个 Ser14 残基的磷酸化引发。糖原磷酸化酶参与糖原分解过程,其磷酸化的异常会造成血糖水平异常,促进糖尿病的发生。糖原磷酸化酶的抑制剂 CPI-91149 就有用于 2 型糖尿病研究的潜能。
磷酸酶
磷酸酶具有与蛋白激酶相反的功能,通过将磷酸单酯水解成一个磷酸基团和一个带有游离羟基的分子来去除磷酸化的蛋白质中的磷酸基团。去磷酸化作用同样主要发生在丝氨酸、苏氨酸和酪氨酸残基上。蛋白磷酸酶之间的结构差异性较大,并不像蛋白激酶一样具有相似的三维催化结构域。磷蛋白磷酸酶 (phosphoprotein phosphatases, PPPs) 家族成员包括 PP1、PP2A、PP2B、PP4、PP5、PP6 和 PP7 蛋白,它们的催化亚基多与各种的调节亚基相结合。而以 PP2C 蛋白为代表金属依赖型蛋白磷酸酶 (metal-dependent protein phosphatases, PPMs) 家族成员不具有调节亚基,并且催化过程依赖于金属离子如 Mn2+/Mg2+。这一特点使得蛋白磷酸酶的识别工作较为困难。
鉴于多种蛋白激酶的活化与癌症的发生相关,人们*初预计蛋白磷酸酶是肿瘤的抑制因子。PTEN 蛋白激酶通过脂质磷酸酶功能抑制磷脂酰肌醇-3-激酶 (PI3K) 的活性,被确定为重要的肿瘤抑制因子。除此之外,在酪氨酸磷酸酶 (protein tyrosine phosphatases, PTPs) 家族中发现了一些潜在的肿瘤抑制因子,包括 DEP1,PTPκ,PTPρ 以及 PTPγ 等。出人意料的是由 PTPN11 基因编码的 SHP2 蛋白的激活会增加肿瘤的发生的风险。SHP2 蛋白激活 Ras 激酶,并使 ERK 激酶/丝裂原活化蛋白激酶活化,参与细胞生长和分化。对于蛋白磷酸酶的的相关研究仍处于起步阶段,许多蛋白磷酸酶仍未被鉴定分析。
蛋白激酶/磷酸酶与药物开发
前期,研发人员的思路是针对具有特定生理功能的蛋白激酶/磷酸酶开发出一系列的小分子药物。例如 ROCK 激酶 (Rho-associated coiled-coil containing kinases) 属于丝氨酸/苏氨酸蛋白激酶家族,在调节肌动蛋白细胞骨架影响细胞运动、调节血管张力方面发挥重要作用。所以 ROCK 激酶被认为是许多心血管疾病发生的重要调节分子。事实上,ROCK 激酶的抑制剂 Fasudil (也叫作 HA1077 或 AT877) 确实被证实可用于改善如高血压,心绞痛,缺血性卒中等心血管疾病症状。蛋白激酶/磷酸酶调控的信号通路参与了几乎所有类型的癌症的发生和发展。以酪氨酸激酶为例,EGFR 受体的酪氨酸残基发生磷酸化,与下游的信号分子结合进而激活 Ras/Raf/MAPK 或 PI3K/Akt 信号通路,调节肿瘤细胞的存活,增殖和转移。很多针对 EGFR 受体的抑制剂是迄今为止*成功的靶向癌症治疗实例,如 Erlotinib,Gefitinib,Lapatinib 等。Sorafenib 也是用于肿瘤治疗的酪氨酸激酶抑制剂的典型代表,它是一种多靶点的酪氨酸激酶抑制剂,包括血管内皮生长因子受体 (参与血管发生与生长,创伤修复,炎症等过程),c-Kit 激酶和 Raf 激酶等,具有显著的抗肿瘤血管生成以及诱导肿瘤细胞凋亡的作用。
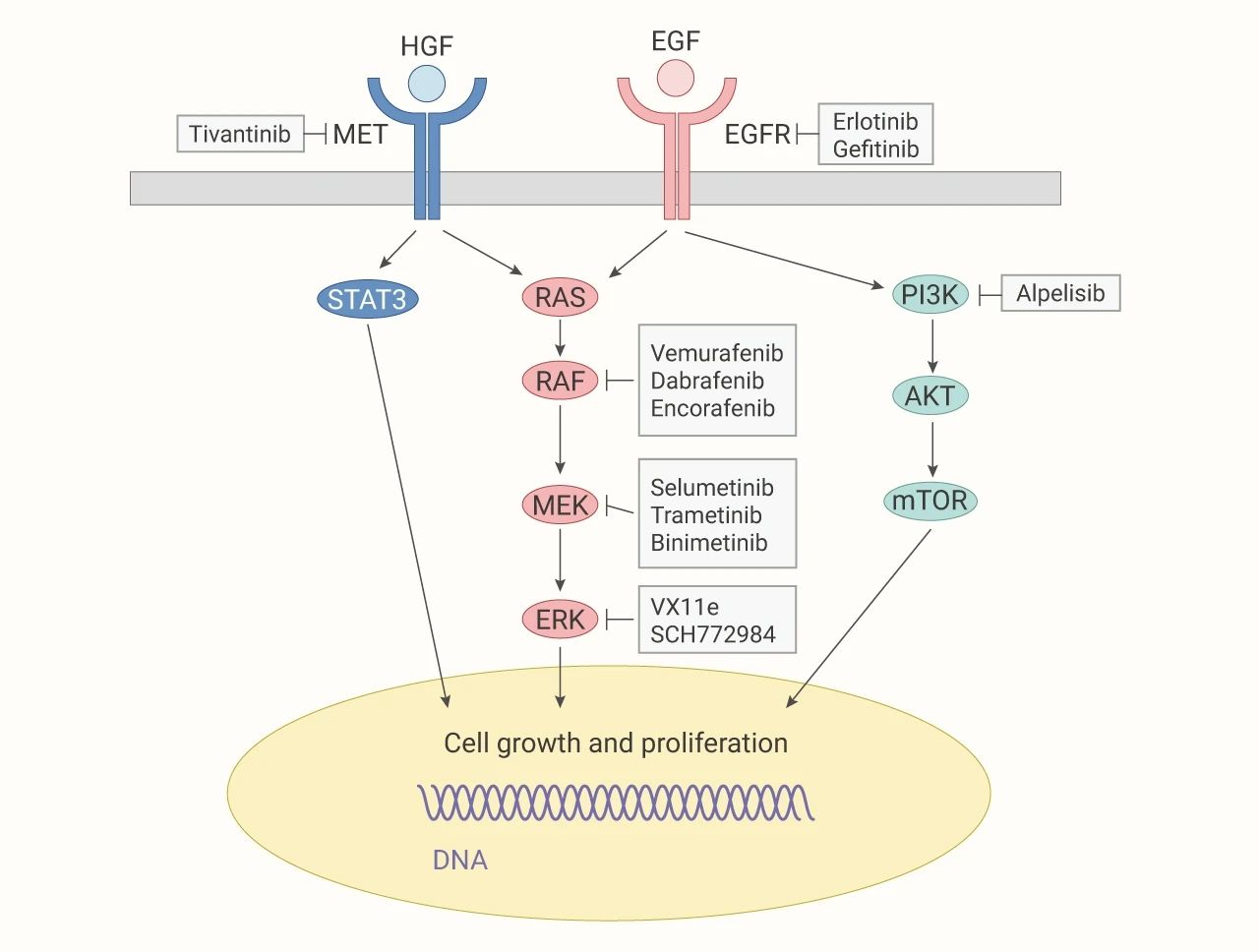
图 3. 靶向 EGFR 通路[3]
虽然目前已有很多以蛋白激酶作为靶点的药物上市,但是靶向磷酸酶的药物却很难找到。与磷酸酶的活性结构域结合的配体大多数是极性分子,而极性化合物通常不适合口服,生物利用度低,细胞膜渗透性也比较差。许多靶向磷酸酶活性结构域的药物开发以失败告终,不断的失败让很多人认为磷酸酶是不适合作为药物开发的靶点。
为攻克这一难题,研发人员尝试寻找不与磷酸酶的活性结构域结合的配体。SHP2 蛋白 (由 PTPN11 基因编码的酪氨酸磷酸酶,通过 MAPK 信号通路参与细胞生长和分化) 的抑制剂 TNO155 采用别构抑制的策略让人们重新看到了靶向磷酸酶的药物开发的希望。TNO155 与 SHP2 的非活性结构域结合引起 SHP2 的构象变化、从而抑制 SHP2 的酶活性。
蛋白激酶/磷酸酶的种类繁多,调节细胞众多的生理过程。这意味着蛋白激酶/磷酸酶可以成为多种疾病的的药物靶点,随着人们对蛋白激酶/磷酸酶的了解加深,以蛋白激酶/磷酸酶为靶点的药物开发也越发受到人们的重视。
总结:
蛋白激酶/磷酸酶调节蛋白质磷酸化,调控胞内多种信号通路,对于细胞行使正常生理功能有重要作用。蛋白激酶/磷酸酶的相关研究不仅帮助我们了解细胞各种生理活动机制,还对于疾病的治疗具有重要的意义。
| 相关产品 |
| CP-91149 糖原磷酸化酶的抑制剂。可用于 2 型糖尿病研究。 |
| Fasudil hydrochloride ROCK 激酶的抑制剂,可用于改善心血管疾病。 |
| Erlotinib EGFR 酪氨酸激酶抑制剂,可降低完整肿瘤细胞的 EGFR 自磷酸化,具有抗肿瘤活性。 |
| Gefitinib EGFR 酪氨酸激酶抑制剂,可以阻断 EGFR 自磷酸化,还可诱导细胞自噬,具有抗肿瘤活性。 |
| Lapatinib ErbB-2 和 EGFR 酪氨酸激酶结构域的有效抑制剂,对 EGFR 和 ErbB-2 的 IC50 值分别为 10.2 和 9.8 nM。 |
| Sorafenib 多靶点的酪氨酸激酶抑制剂,具有显著的抗肿瘤血管生成以及诱导肿瘤细胞凋亡的作用。 |
| TNO155 SHP2 的变构抑制剂,与 SHP2 非活性结构域结合引起 SHP2 的构象变化、从而抑制 SHP2 的酶活性。 |
| 磷酸酶抑制剂 CocktailⅠ (100× in DMSO) 含有 (-)-p-Bromotetramisole oxalate、Cantharidin 和 Microcystin LR、Microcystis aeruginosa 成分,可以有效的抑制碱性磷酸酶和丝氨酸/苏氨酸磷酸酶,用于维持蛋白的磷酸化状态。 |
| 磷酸酶抑制剂 Cocktail Ⅱ (100× in ddH2O) 含有 Sodium Fluoride、Sodium Orthovanadate、Sodium Tartrate Dihydrate、Sodium Molybdate 和 Imidazole 成分,可以广谱的抑制酸性磷酸酶、碱性磷酸酶和蛋白酪氨酸磷酸酶。 |
| 磷酸酶抑制剂 Cocktail Ⅲ (100× in DMSO) 含有 (-)-p-Bromotetramisole oxalate、Cantharidin 和 Calyculin A 成分,可以有效的抑制 PP1、PP2A 和碱性磷酸酶。 |
| 激酶抑制剂库 收录了 1900+ 种激酶抑制剂和调节因子,主要靶向对蛋白激酶、脂质激酶和碳水化合物激酶 (己糖激酶),是激酶药物开发及相关研究的有用工具。 |
| 酪氨酸激酶化合物库 收录了 500+ 种酪氨酸激酶信号通路相关的产品,可以用于酪氨酸激酶相关药物筛选及疾病研究。 |
| 磷酸酶抑制剂库 收录了 70+ 种磷酸酶抑制剂,主要靶向蛋白丝氨酸/苏氨酸磷酸酶和蛋白酪氨酸磷酸酶,是磷酸酶药物开发及相关研究的有用工具。 |
参考文献
1. Ardito F, Giuliani M, Perrone D, Troiano G, Lo Muzio L. The crucial role of protein phosphorylation in cell signaling and its use as targeted therapy (Review). Int J Mol Med. 2017 Aug;40(2):271-280.
2.Kobe B, Kampmann T, Forwood JK, Listwan P, Brinkworth RI. Substrate specificity of protein kinases and computational prediction of substrates. Biochim Biophys Acta. 2005 Dec 30;1754(1-2):200-9.
3. Miyamoto Y, Suyama K, Baba H. Recent Advances in Targeting the EGFR Signaling Pathway for the Treatment of Metastatic Colorectal Cancer. Int J Mol Sci. 2017 Apr 2;18(4):752.
4.Nishi H, Fong JH, Chang C, Teichmann SA, Panchenko AR. Regulation of protein-protein binding by coupling between phosphorylation and intrinsic disorder: analysis of human protein complexes. Mol Biosyst. 2013 Jul;9(7):1620-6.
5. Kornev AP, Taylor SS. Defining the conserved internal architecture of a protein kinase. Biochim Biophys Acta. 2010 Mar;1804(3):440-4.
6. Nishi H, Shaytan A, Panchenko AR. Physicochemical mechanisms of protein regulation by phosphorylation. Front Genet. 2014 Aug 7;5:270.
7. Shi Y. Serine/threonine phosphatases: mechanism through structure. Cell. 2009 Oct 30;139(3): 468-84.
8. Tonks NK. Protein tyrosine phosphatases: from genes, to function, to disease. Nat Rev Mol Cell Biol. 2006 Nov;7(11):833-46.
9. Cohen P. Protein kinases-the major drug targets of the twenty-first century Nat Rev Drug Discov. 2002 Apr;1(4):309-15