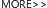企业档案
会员类型:会员

已获得易推广信誉 等级评定
(0 -40)基础信誉积累,可浏览访问
(41-90)良好信誉积累,可接洽商谈
(91+ )优质信誉积累,可持续信赖
易推广会员:8年
最后认证时间:
注册号: 【已认证】
法人代表: 【已认证】
企业类型:生产商 【已认证】
注册资金:人民币万 【已认证】
产品数:91228
参观次数:11306896
技术文章
酪氨酸激酶的抑制剂——白血病的靶向研究 | MedChemExpress
点击次数:389 发布时间:2021/9/17 14:33:30
近年来白血病 (Leukemia) 的发病率逐渐走高,在我国每年每 10 万人中约有 3-4 人患上白血病。急性淋巴细胞白血病 (ALL) 多见于儿童 (≤ 14 岁) 和青少年,2018 年的一项研究发现,白血病是 0-14 岁儿童*常见的癌症和主要死因,而且在所有死于癌症的儿童患者中,白血病患者占比大约三分。而急性髓系白血病 (AML)、慢性髓系白血病 (CML)、慢性淋巴细胞白血病 (CLL) 的发病率与年龄相关,常见于成人,尤其是老年人。此外,男性的白血病患病率普遍高于女性。
根据白血病细胞分化程度,白血病可分为急性及慢性两大类。根据癌变的细胞类型,可以分为粒细胞、单核细胞、淋巴细胞白血病等。通常把白血病分为四个亚型:急性髓系白血病 (AML)、急性淋巴细胞白血病 (ALL)、慢性髓系白血病 (CML) 和慢性淋巴细胞白血病 (CLL)。
白血病的发生
目前,白血病的发生机制仍未被全了解。研究者普遍认为白血病是由多种因素共同引起的,危险因素包括环境因素,病毒因素以及遗传改变。
环境因素包括电离辐射暴露、染发剂、装修产生的甲醛、杀虫剂等都可以诱发白血病。此外,病毒也可能是白血病发生的诱因,哺乳动物 C 型 Oncorna 病毒 (致癌 RNA 病毒) 在鼠、猫、鸡和牛等动物体内的致白血病作用已经得到肯定,近年也有报道,从成人 T 细胞白血病和淋巴瘤患者分离出了人类 T 细胞白血病病毒 (HTLV,一种 C 型逆转录病毒)。
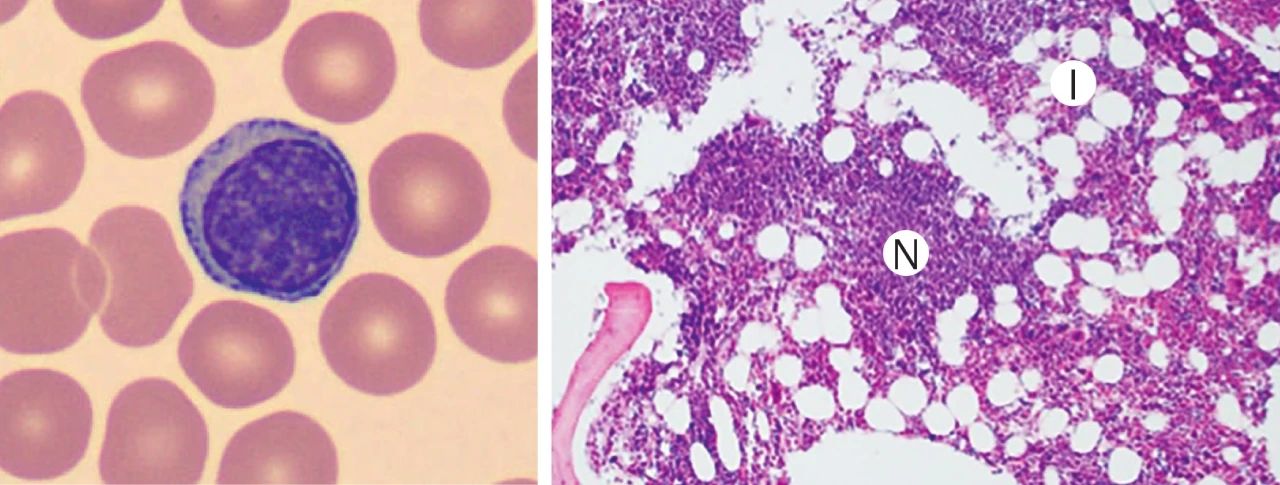
不同类型的白血病的遗传特征有所不同。目前遗传机制较为清楚的是慢性髓系白血病。慢性髓系白血病的发生与 BCR-ABL1 融合基因的存在密切相关。BCR-ABL1 融合基因是 9 号染色体上的 ABL1 基因和 22 号染色体 (费城染色体) 上的 BCR 基因融合而成。
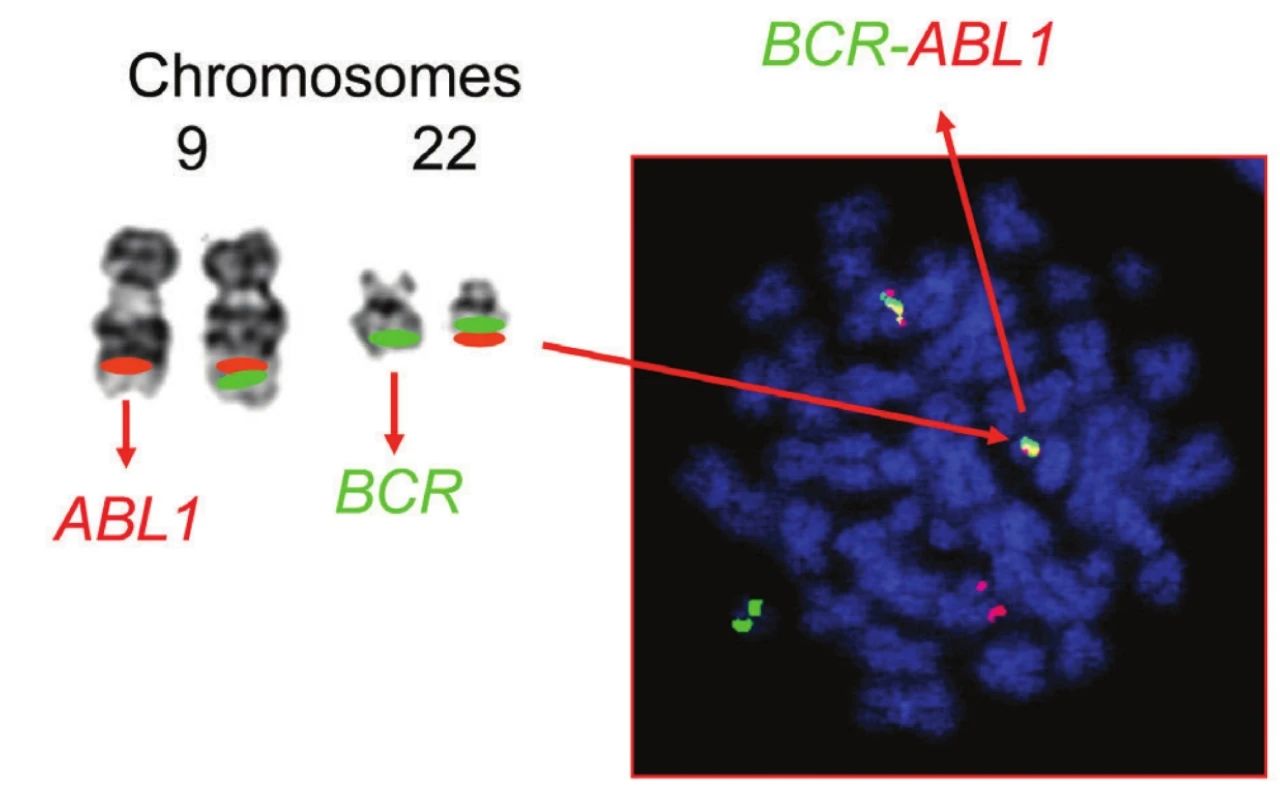
BCR-ABL1 融合基因可以编码致癌蛋白 BCR-ABL1 (也称为 p210),具有酪氨酸激酶活性。BCR-ABL1 蛋白通过下游因子/信号途径如 Ras、磷脂酰肌醇-3-激酶 (PI3K)、JAK/STAT通路等,调控细胞生长、增殖、凋亡,干扰细胞粘附和迁移过程,来诱导白血病的发生。目前,BCR-ABL1 融合基因已经成为慢性髓系白血病研究的重要靶点。
除慢性髓系白血病之外,其他白血病的遗传改变类型多样,具有异质性,包括基因异位重排、基因序列突变和表观遗传修饰等。
目前,在急性淋巴细胞白血病中 KMT2A、PAX5 基因重排,基因异位产生的融合基因 ETV6-RUNX1、CF3-PBX1,以及融合基因 BCR-ABL1、FBXW7 等已被报道。而在急性髓细胞白血病中发现 FLT3、KRAS、NRAS、KIT、PTPN11、IDH1/2、TET2、ASXL1 和 DNMT3A 等基因的突变。这些突变主要与细胞信号通路或激酶的异常激活以及表观遗传调控有关。慢性淋巴细胞白血病通常是由染色体物质的丢失或增加引起的,包括 11 号、13 号和 17 号染色体的缺失,12 号染色体三体等。
值得一提的是,这些突变并不一定是单独存在的,同时存在多个突变会导致白血病的侵袭性增强。
但是这些非特异性的毒性药物的毒副作用较为明显,开发更安全的靶向治疗药物是未来肿瘤准确治疗的趋势。近年来,准确靶向免疫疗法例如 CAR-T 细胞 (嵌合抗原受体 T 细胞) 的风头很盛,靶向药物的开发也是如火如荼,目前,针对白血病开发的靶向治疗药物有酪氨酸激酶抑制剂,BCL-2 抑制剂,IDH 抑制剂等。
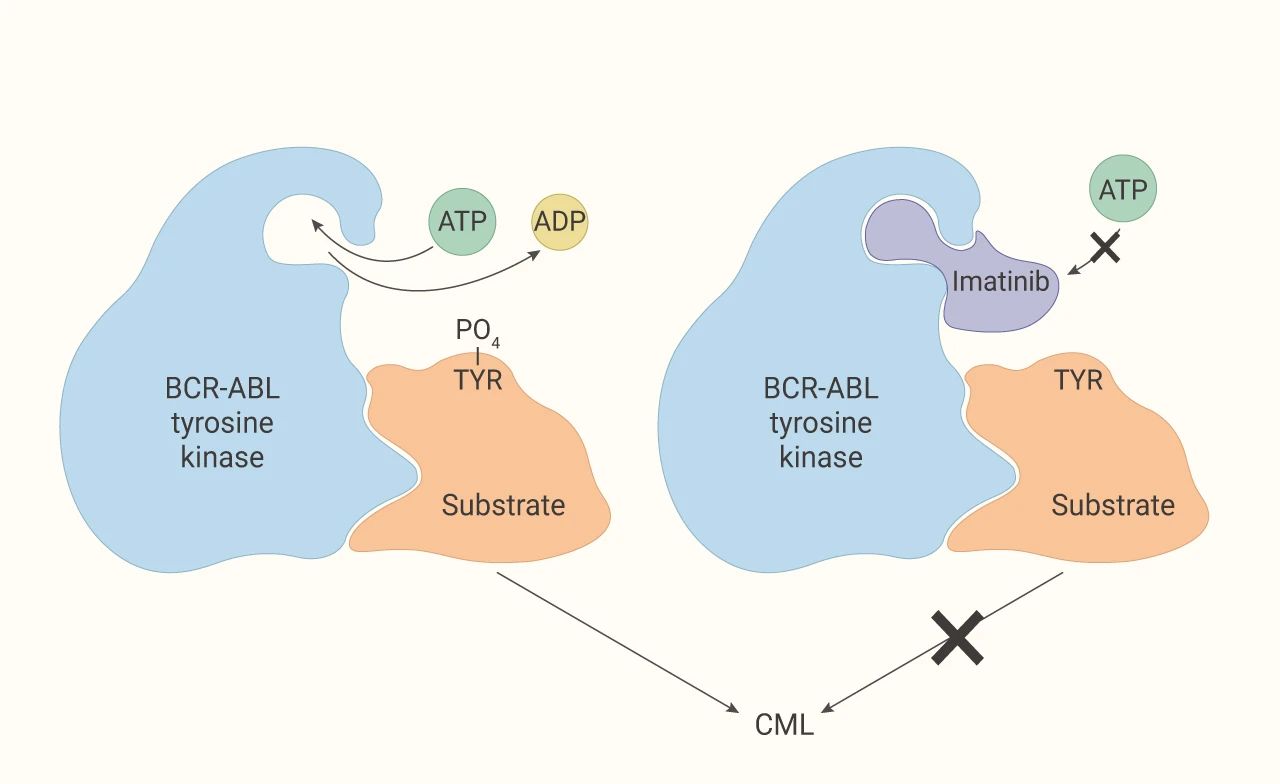
■ 酪氨酸激酶的抑制剂
多种酪氨酸激酶抑制剂能广泛用于含有酪氨酸激酶基因突变癌症 (包括白血病) 的研究。例如伊马替尼 (Imatinib),具有抑制蛋白激酶 C (PKC) 的活性,也是 c-KIT 受体和血小板衍生生长因子受体 (PDGFR) 的抑制剂,可以竞争性地结合酪氨酸激酶的 ATP 结合区域,抑制酪氨酸激酶与 ATP 的结合,从而抑制其活性。伊马替尼对于 BCR-ABL 融合基因诱导的酪氨酸激酶活性有很好的抑制活性。但是伊马替尼耐药性的出现也是不可忽视的问题。
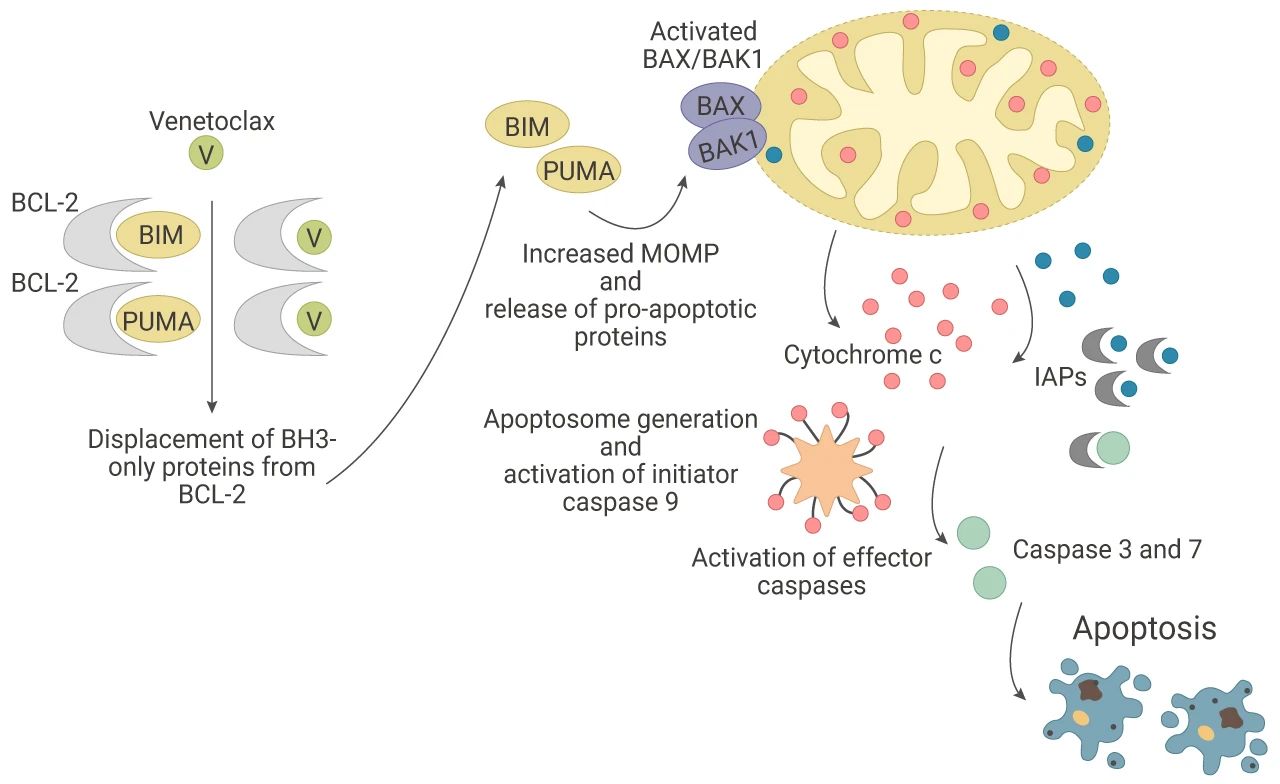
■ BCL-2 抑制剂
B 细胞白血病/淋巴瘤 2 (BCL-2) 蛋白是内在的线粒体凋亡途径的关键调节因子。BCL-2 蛋白由 BCL-2 原癌基因编码,含有 BH1-BH4 四个同源结构域和一个跨膜结构域,其中 BH4 构域可以与促细胞凋亡蛋白 (如 BIM 蛋白、BIK 蛋白、PUMA 蛋白等) 的 BH3 结构域相结合,抑制促细胞凋亡蛋白发挥作用。因此,BCL-2 蛋白的过表达会抑制细胞凋亡,促进细胞存活。
以维奈克拉 (Venetoclax) 为代表的 BCL-2 抑制剂可以竞争性结合 BCL-2 蛋白的 BH4 结构域,阻碍 BCL-2 蛋白与促细胞凋亡蛋白结合,促细胞凋亡蛋白发挥作用,诱导肿瘤细胞凋亡。
■ IDH 抑制剂
异柠檬酸脱氢酶 (IDH) 包括了细胞质中的 NADP-IDH1,线粒体中的 NADP-IDH2 和 NAD-IDH3。IDH 在三羧酸循环中扮演重要角色,被认为是三羧酸循环的限速酶,与组蛋白修饰、DNA 甲基化等关键表观遗传密切相关。正常情况下,IDH 可催化异柠檬酸脱氢为 α-酮戊二酸 (α-KG),但突变的 IDH 蛋白会将 α-KG 还原成 2-羟基戊二酸 (D-2-HG)。异常积累的 D-2-HG 抑制了参与表观遗传学和分化调控的 α-KG 依赖性双加氧酶,并被认为通过诱导表观遗传学功能障碍来抑制正常细胞分化,*终诱发细胞癌变。IDH 抑制剂药物如艾伏尼布 (Ivosidenib) 可以特异性地抑制突变型 IDH1,降低细胞内 D-2-HG 水平。
■ 靶向白血病的抗体
近些年针对白血病的抗体药物也越来越多,如靶向 CD19 和 CD3 的博纳吐单抗 (Blinatumomab),靶向 CD20 的奥滨尤妥珠单抗 (Obinutuzumab),靶向 CD20 的利妥昔单抗 (Rituximab) 等。
白血病相关的治疗仍有很多问题亟待解决,预后又发,耐药性的产生等问题促使人们继续探索毒副作用更小的靶向药物和更为准确化的治疗方案。人类克服白血病之路困难重重,科研人员任重而道远。
| 非特异性的细胞毒性化合物 |
| Cyclophosphamide Nitrogen mustard 类化合物,属于烷化剂,可与 DNA 结合并破坏 DNA,具有抗肿瘤及免疫抑制活性。 |
| Teniposide 足叶草毒素衍生物,是拓扑异构酶 II 的抑制剂。 |
| Idarubicin hydrochloride 属于蒽环类化合物,是拓扑异构酶 II 抑制剂,干扰 DNA 复制和 RNA 转录。 |
| Cytarabine 属于核苷类似物,可引起 S 期细胞周期停滞并抑制 DNA 聚合酶。 |
| Vincristine sulfate 长春花生物碱,能抑制有丝分裂纺锤体的形成,导致中期阶段的分裂细胞停滞。 |
| Hydroxyurea 核苷二磷酸还原酶抑制剂,可阻止核苷酸还原为脱氧核苷酸,干扰嘌呤及嘧啶碱基生物合成,选择性地阻碍 DNA 合成,对 RNA 及蛋白质合成无阻断作用。 |
| 6-Thioguanine 抑制嘌吟合成途径的嘌吟代谢拮抗物,抑制核酸的生物合成。 |
| 小分子抑制剂 |
| Imatinib 酪氨酸激酶的抑制剂,可选择性地抑制 BCR/ABL、v-Abl、PDGFR、c-KIT 等激酶活性。 |
| Venetoclax Bcl-2 抑制剂,可以诱导自噬,具有抗白血病活性。 |
| 化合物库 |
| 抗血液癌症化合物库 收录了 1500+ 种具有明确或潜在抗血液肿瘤活性的化合物,这些化合物靶向血液肿瘤治疗中的关键靶点及信号通路,是筛选抗血液肿瘤活性化合物及其他相关研究的重要工具。 |
缩写
AML: Acute myeloid leukemia,
ALL: Acute lymphoblastic leukemia,
CML: Chronic myeloid leukemia
CLL: Chronic lymphoblastic leukemia
HTLV: Human T-cell leukemia virus type 1
PI3K: Phosphatidyl inotisol-3-kinase
BCL-2: B-cell leukemia/lymphoma-2
PKC: Protein kinase C
PDGFR:Platelet derived growth factor receptor
BIM: Bcl-2 interacting mediator of cell death
BIK: BCL-2 interacting killer
PUMA: p53 upregulated modulator of apoptosis
IDH: Isocitrate dehydrogenase
α-KG: α-ketoglutarate
D-2-HG: D-2-hydroxyglutarate
参考文献
1. Kipps TJ, Stevenson FK, Wu CJ, Croce CM, Packham G, Wierda WG, et al. Chronic lymphocytic leukaemia. Nat Rev Dis Primers. 2017 Jan 19;3:16096.
2. Rosewick N, Durkin K, Artesi M, Marçais A, Hahaut V, Griebel P, Arsic N, et al. Cis-perturbation of cancer drivers by the HTLV-1/BLV proviruses is an early determinant of leukemogenesis. Nat Commun. 2017 May 23;8:15264.
3. Poiesz BJ, Ruscetti FW, Gazdar AF, Bunn PA, Minna JD, Gallo RC. Detection and isolation of type C retrovirus particles from fresh and cultured lymphocytes of a patient with cutaneous T-cell lymphoma. Proc Natl Acad Sci U S A. 1980 Dec;77(12):7415-9.
4. Mughal TI, Radich JP, Deininger MW, Apperley JF, et al. Chronic myeloid leukemia: reminiscences and dreams. Haematologica. 2016 May;101(5):541-58.
5. DiNardo CD, Cortes JE. Mutations in AML: prognostic and therapeutic implications. Hematology Am Soc Hematol Educ Program.2016 Dec 2;2016(1):348-355.
6. Iacobucci I, Mullighan CG. Genetic Basis of Acute Lymphoblastic Leukemia. J Clin Oncol. 2017 Mar 20;35(9):975-983.
7. Rai KR, Jain P. Chronic lymphocytic leukemia (CLL)-Then and now. Am J Hematol. 2016 Mar;91(3):330-40. 8. Carroll M, Ohno-Jones S, Tamura S, Buchdunger E, Zimmermann J, et al. CGP 57148, a tyrosine kinase inhibitor, inhibits the growth of cells expressing BCR-ABL, TEL-ABL, and TEL-PDGFR fusion proteins. Blood. 1997 Dec 15;90(12):4947-52.9. Hallek M. Chronic lymphocytic leukemia: 2020 update on diagnosis, risk stratification and treatment. Am J Hematol. 2019 Nov;94(11):1266-1287.
10. Komorowski L, Fidyt K, et al. Philadelphia Chromosome-Positive Leukemia in the Lymphoid Lineage-Similarities and Differences with the Myeloid Lineage and Specific Vulnerabilities. Int J Mol Sci. 2020 Aug 12;21(16):5776.
11. Warren CFA, Wong-Brown MW, Bowden NA. BCL-2 family isoforms in apoptosis and cancer. Cell Death Dis. 2019 Feb 21;10(3):177. 12. Kapoor I, Bodo J, Hill BT, et al. Targeting BCL-2 in B-cell malignancies and overcoming therapeutic resistance. Cell Death Dis. 2020 Nov 2;11(11):941. 13. Dang L, Yen K, Attar EC. IDH mutations in cancer and progress toward development of targeted therapeutics. Ann Oncol. 2016 Apr;27(4):599-608.
14. Waitkus MS, Diplas BH, Yan H. Biological Role and Therapeutic Potential of IDH Mutations in Cancer. Cancer Cell. 2018 Aug 13;34(2):186-195