企业档案
会员类型:会员

已获得易推广信誉 等级评定
(0 -40)基础信誉积累,可浏览访问
(41-90)良好信誉积累,可接洽商谈
(91+ )优质信誉积累,可持续信赖
易推广会员:8年
最后认证时间:
注册号: 【已认证】
法人代表: 【已认证】
企业类型:生产商 【已认证】
注册资金:人民币万 【已认证】
产品数:91228
参观次数:11305214
技术文章
PROTAC—小分子化合物蛋白降解技术 | MedChemExpress
点击次数:472 发布时间:2021/10/13 17:01:16
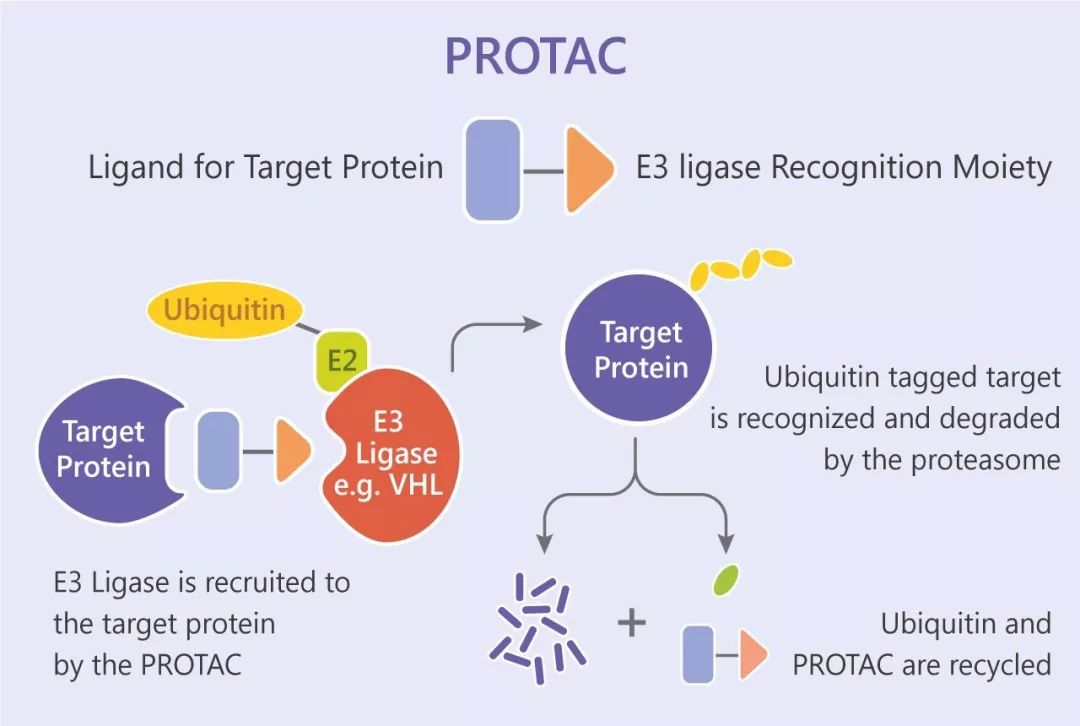
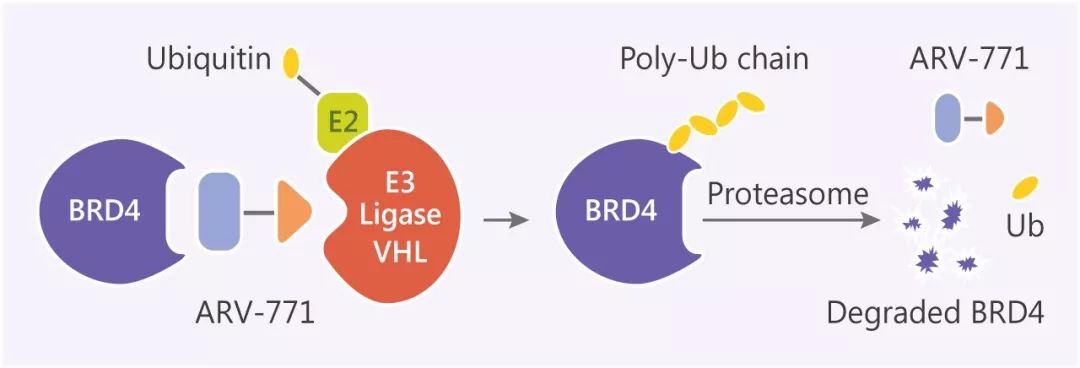
PROTAC 是一种杂合双功能小分子化合物,结构中含有两种不同配体,一个是泛素连接酶 E3 配体,另一个是与细胞中目标靶蛋白结合的配体,两个配体之间通过 Linker 相连,从而形成“三体”聚合物——靶蛋白配体-Linker-E3 配体。然后通过 E3 连接酶给靶蛋白加上泛素化标签,启动细胞内强大的泛素化水解过程,通过泛素-蛋白酶体途径特异性地降解靶蛋白。
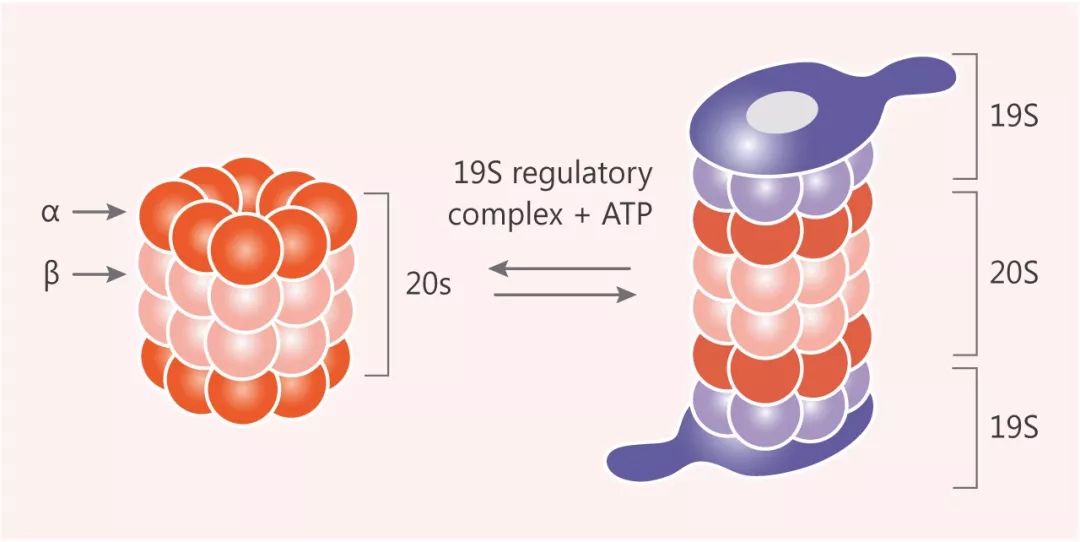
泛素-蛋白酶体途径
细胞中的很多信号通路是通过泛素-蛋白酶体途径选择性降解某些关键调控蛋白来实现调控的。细胞内每时每刻都有数以千计的蛋白泛素化过程在进行,这种对特定蛋白高度特异的识别机制主要是由 E3 泛素连接酶决定的。
泛素-蛋白酶体途径(ubiquitin-proteasome pathway, UPP):是细胞内蛋白降解的主要途径,参与细胞内 80% 以上蛋白质的降解。泛素分子在一系列酶作用下,将细胞内的蛋白质分类,从中选出靶蛋白分子,对靶蛋白进行特异性修饰的过程,形成靶蛋白多聚泛素链。这些酶包括泛素激活酶(E1),泛素结合酶(E2)、泛素连结酶(E3)等。这一过程是一个三酶级联反应。靶蛋白被泛素(多肽)标记,然后被蛋白酶体识别和降解。通过这样一个需要消耗能量的过程,细胞以高度特异方式对不需要的蛋白进行降解。值得一提的是,泛素化过程也是可逆的,泛素可被去泛素化酶(Deubiquitinase, DUB)从泛素链上去除,形成反向调节。
泛素化在蛋白质的代谢、调节和降解中起重要作用,蛋白质泛素化是生物体内一种常见的翻译后修饰,同时参与细胞周期、凋亡、分化等几乎一切生命活动的调控。泛素化与肿瘤、心血管、自身免疫等疾病的发病密切相关。

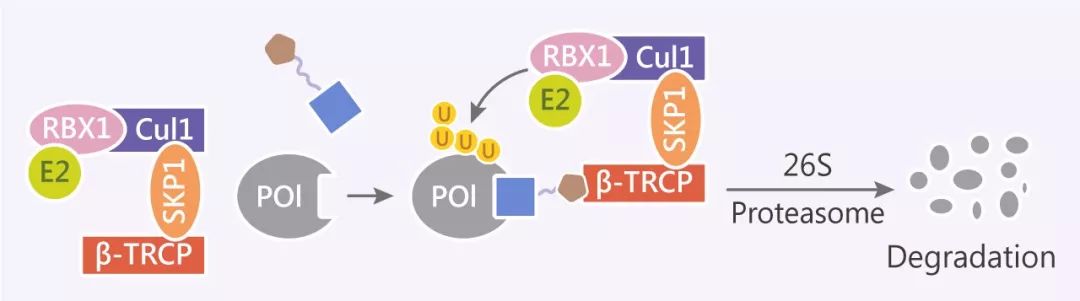
多样化的 E3 连接酶
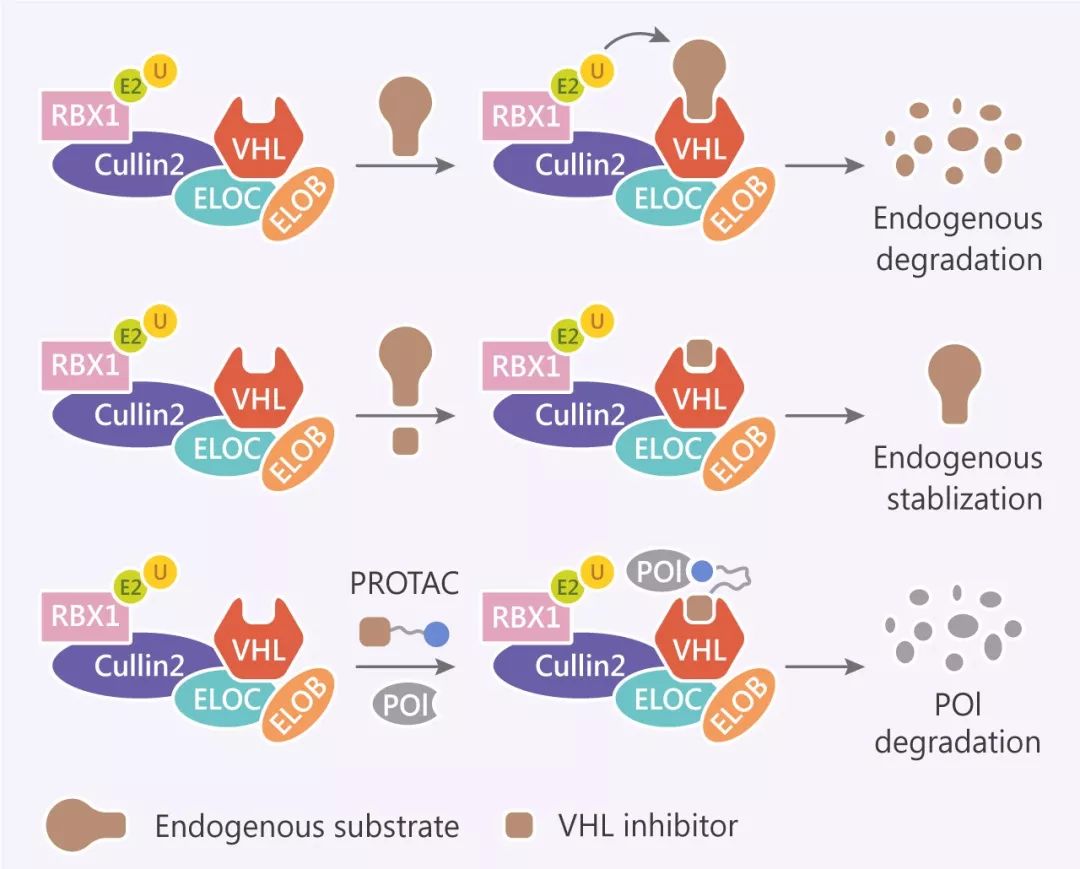
目前已经发现有 600 多种 E3 泛素连接酶复合体,下面介绍研究*热的 2 种:von Hippel-Lindau (VHL) 型和 Cereblon (CRBN) 型。
Cullin (Cul) 家族可形成调节细胞周期的活性复合体。Cullin (Cul) 家族有 6 个成员蛋白Cul1, Cul2,Cul3, Cul4, Cul5, Cul7。
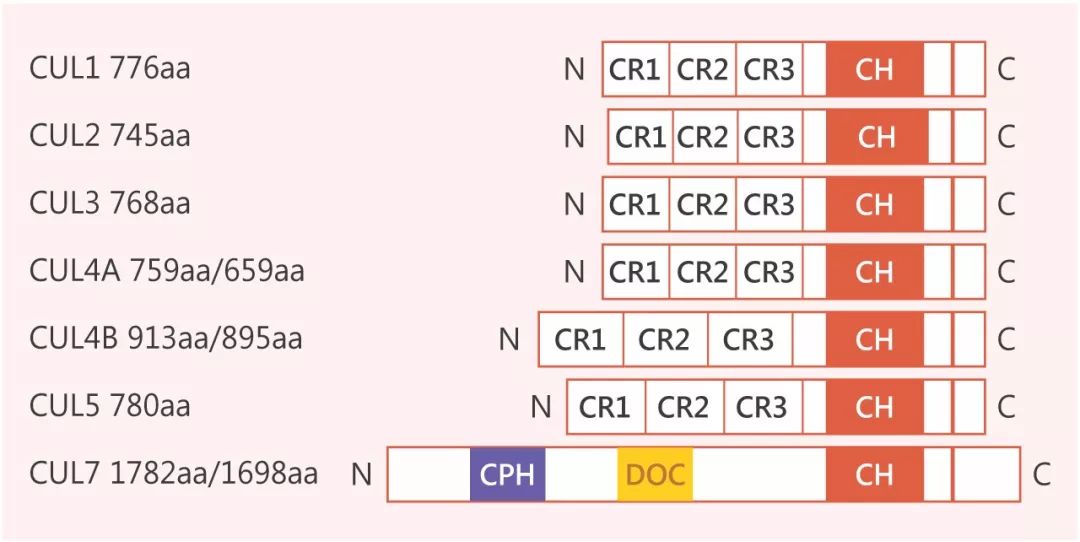
N 端有 Cul 重复结构 (Cul repeat, CR)
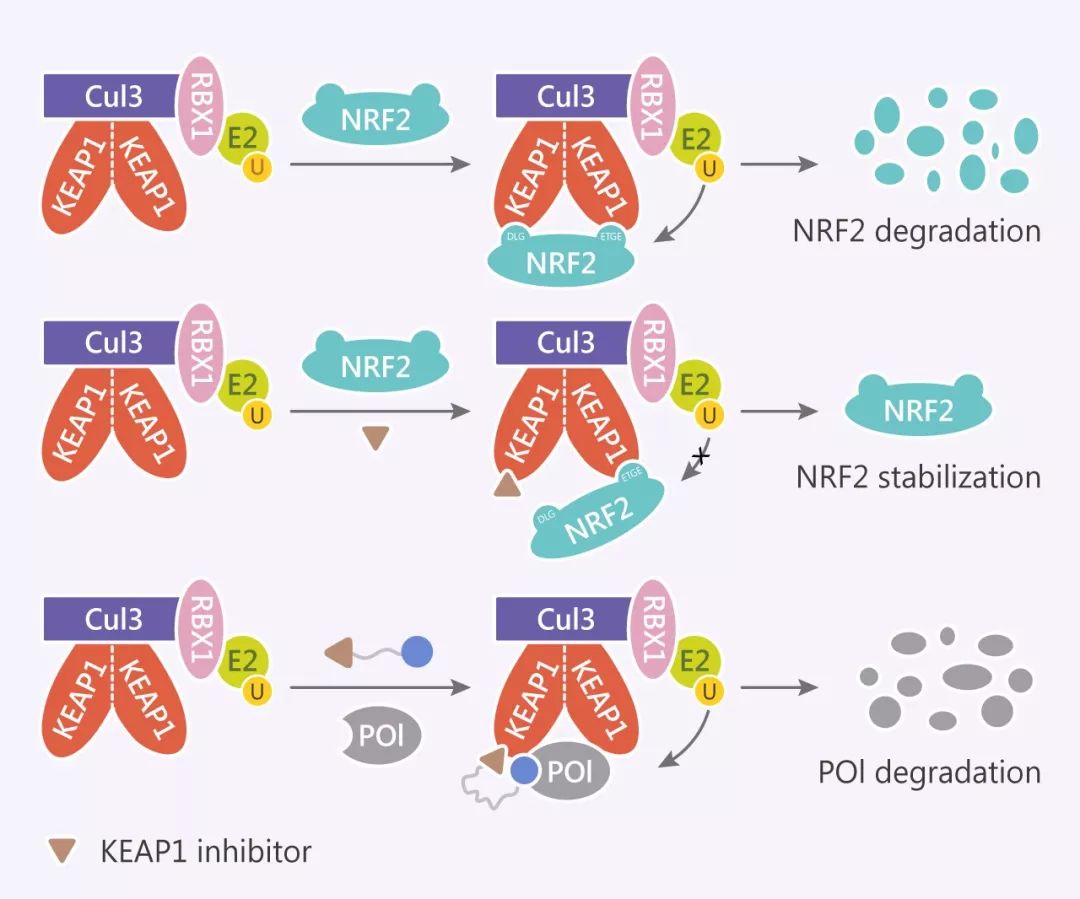
一种:Von Hippel-Lindau (VHL) 型 E3 泛素连接酶复合体
PEG 类
Alkyl/ether 类
PROTAC Linker 2 is a Alkyl/ether based PROTAC linker.
SNIPER
Bestatin 是一种氨肽酶抑制剂。其甲酯化合物(MeBS)可通过 Bestatin 结构端与 cIAP1 的 BIR3 结构域结合,激活 cIAP1 的 E3 泛素化连接酶活性,诱导 cIAP1 发生字泛素化,然后被蛋白酶体降解。所以,在 MeBS 通过 linker 连接不同靶蛋白的小分子抑制剂,可以得到多个基于 cIAP1 E3 泛素化连接酶的 PTOTAC。但是,由于 MeBS 可以诱导 cIAP1 自身发生泛素化降解,因此很多基于此技术得到的 PTOTAC 在降解目标靶蛋白的同时会泛素化降低 cIAP1,导致很大程度上限制了其降低靶蛋白的效率。
聪明的科学家们继续对 Bestatin 做进一步的结构改造,发现 Bestatin 的酰胺衍生物保留了与 cIAP1 的结合活性,且不会引起 cIAP1 的自身泛素化降解。如 SNIPER(ABL)-020,SNIPER(ABL)-044 等等。
E3 Ligase Ligand-Linker Conjugate
E3 Ligase Ligand-Linker Conjugate Kit 是一个超级丰富的 E3 配体和 Linker 组合试剂盒。里面是一系列合成的化合物,结合了 E3 Ligase 配体和 Linker。另外还提供了不同的类型的 E3 Ligase 配体和多样化的 Linker 组合任君选择。
1. 用量小,毒性低
小 M 的小思考
鉴于大多数小分子抑制剂的可逆结合,通常需要较大的全身给药浓度和持续暴露以确保足够的抑制。在许多情况下,维持体内足够高的药物浓度具有挑战性的。所以,通过小分子诱导的蛋白降解来消除引起疾病的异常蛋白质正在发展为研究的新策略。PROTAC 技术可能令现在还无法成药的 80% 蛋白组被小分子药物调控。PROTAC 小分子研究进展目前主要集中在可靶向的靶点上。未来潜力是要靶向传统意义上不可靶向的靶点,比如转录因子、蛋白的骨架功能等。