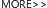众所周知,p53 是一种肿瘤抑制基因,被广泛称为“基因组的守护者”。自 1979 年被发现至今,p53 基因一直是分子生物学和肿瘤学的研究热门。据 Elie Dolgin 在 Nature 上发表的 “The most popular genes in the human genome” 统计,截至 2017 年,PubMed 数据库中研究*多的基因列表——一种人类基因组的“热门基因”,TP53 荣得桂冠。
Gaurav Mendiratta 等人在 2021 年发表的“Cancer gene mutation frequencies for the U.S. population” 中,通过结合基因组 (所有癌症中每个基因中包含一个或多个突变的估计比例) 和流行病学数据也统计了美国人群中基因突变的频率,发现 TP53 是*常见的突变基因 (35%)。
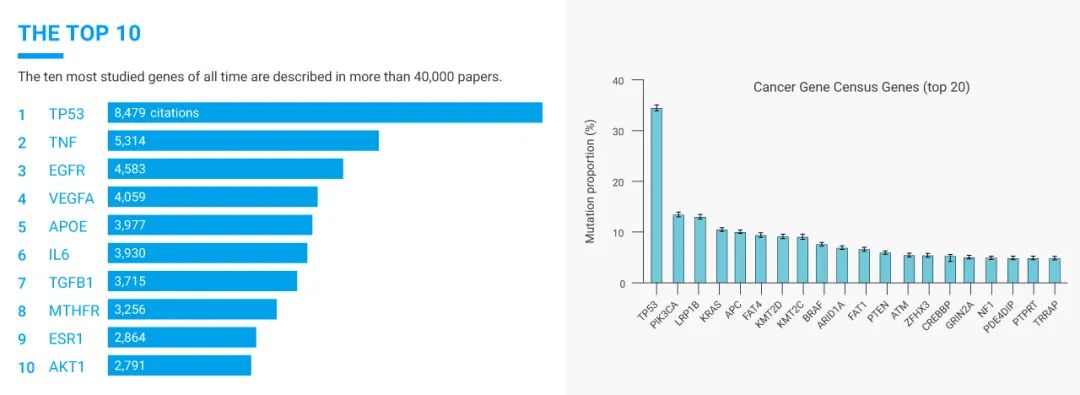
图 1 左:截至 2017 年,PubMed 数据库中研究*多的基因列表[1] 图 1 右:癌症患者群体中重要基因组的流行病学加权基因突变比例[2]
p53 是一种抑癌基因,位于人的 17 号染色体的短臂上,可以编码和表达 p53 蛋白。p53 可以被许多应激信号诱导后,以四聚体形式与 DNA 结合,然后以序列特异性方式参与到某些介导关键细胞过程基因的转录调控中,例如细胞周期停滞、DNA 修复、衰老和细胞凋亡。激活 p53 蛋白信号通路的方法是对 DNA 模板完整性的破坏。如图 2,各种应激导致不同类型的 DNA 损伤,从而通过导致 p53 蛋白磷酸化、乙酰化、甲基化、泛素化或 sumolation 的翻译后修饰。
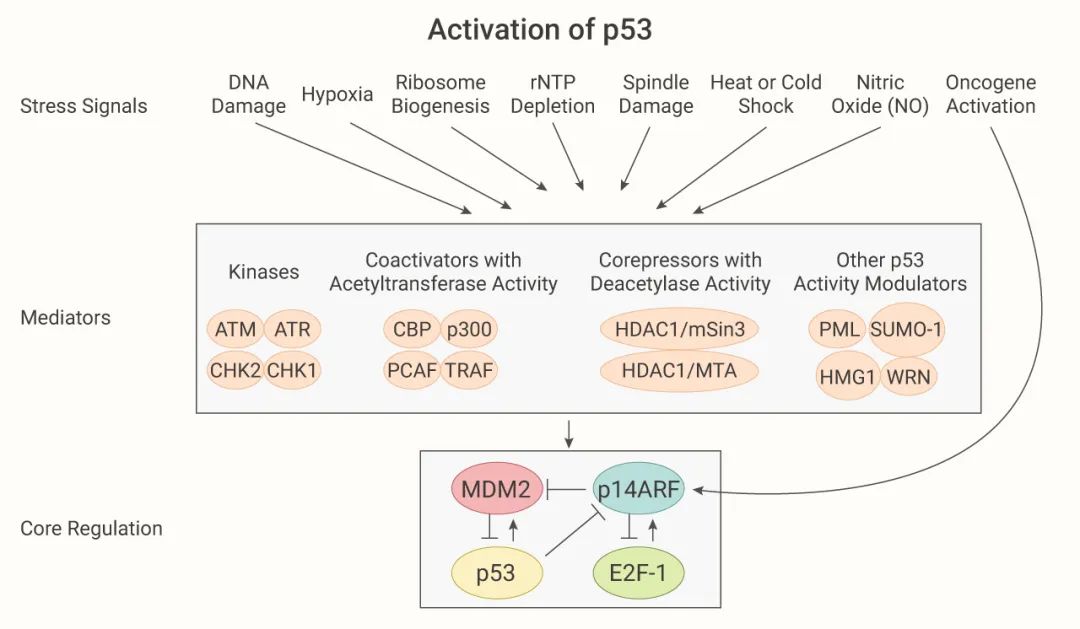
图 2. p53 蛋白作为肿瘤抑制因子的中心作用[4]
铁死亡 (Ferroptosis),是一种新型的调节性细胞死亡形式;其形态学特征是线粒体膜密度浓缩,线粒体嵴减少或消失,线粒体外膜破裂 (见:铁死亡是什么,如何检测?您要的“一文通”来了!)。p53 可以通过抑制 SLC7A11 的表达来增强铁死亡。SLC7A11 是 System x- (抗氧化体系)的亚基,负责主要的转运活性,抑制 System xc- 的活性会抑制胱氨酸的吸收,影响 GSH 的合成,继而导致膜脂修复酶 GPX4 活性降低,使得细胞抗氧化能力降低,从而促进铁死亡。

■ SLC7A11 基因是 p53 介导的转录抑制的目标顾伟团队早在 2015 年于 Nature 上发表的 “Ferroptosis as a p53-mediated activity during tumour suppression” 中已证明 p53 通过抑制 SLC7A11 (胱氨酸/谷氨酸逆向转运蛋白的关键成分) 的表达来抑制胱氨酸摄取,并且使细胞对铁死亡敏感。
如图 4,四环素处理对亲代 H1299 细胞中 SLC7A11 的表达没有明显影响,但在四环素调控 (tet-on) p53 诱导的细胞系中发现,p53 激活严重降低了 SLC7A11 蛋白水平 (图 4a)。当 p53 shRNA (p53 敲低)通过 Nutlin-3 (p53-MDM2 抑制剂) 处理,SLC7A11 蛋白质水平没有受到明显的影响 (图 4b)。这些数据表明 SLC7A11 基因是 p53 介导的转录抑制的靶标。
随后,作者团队使用 p533KR 细胞进行实验,这是一种无法诱导细胞周期停滞、衰老和凋亡的乙酰化缺陷突变体细胞。他们发现在没有 Tet-on 诱导的情况下,p533KR 细胞对 Erastin 介导的铁死亡具有很强的抵抗力,SLC7A11 的过表达会挽救 p533KR 依赖性细胞铁死亡 (图 4c)。此外,在体内外实验中,SLC7A11 的过表达会大大减弱 p533KR 的肿瘤抑制作用 (图 4d-e)。
图 4. SLC7A11 调节 p53 介导的铁死亡[14] a: Doxycycline 处理的 tet-on p53 稳定系细胞的蛋白质印迹;b: Nutlin 处理的 p53 敲低的 U2OS 细胞蛋白质印迹分析;c-d: 用对照或过表达 SLC7A11 的质粒转染 Tet-on p533KR 细胞的铁死亡情况以及细胞的异种移植肿瘤重量 另外作者团队还发现高水平的活性氧 (ROS) 可以触发 p53 介导的铁死亡。
如图 5a,单独的 p533KR 诱导或 ROS 激活剂处理中均未观察到明显的细胞死亡;而 p533KR+ROS 组诱导了大量细胞死亡,SLC7A11 的过表达可以挽救这种死亡(5b)。 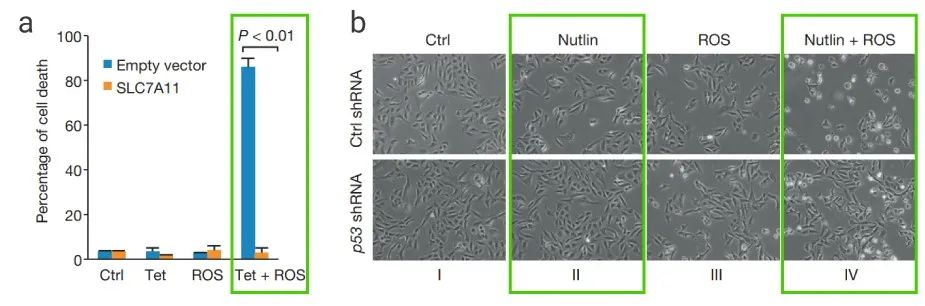
图 5. 高水平的 ROS 对 p53 介导的铁死亡的影响[14] a-b: 四环素和 ROS 处理对照或过表达 SLC7A11 的质粒转染 Tet-on p533KR 细胞的死亡情况;
■ ALOX12 是 p53 介导的铁死亡途径必不可少的 顾伟团队深入研究,于 2019 年在 Nature Cell Biology 上发表了“ALOX12 is required for p53-mediated tumour suppression through a distinct ferroptosis pathway”文章,指出 ALOX12 介导的、不依赖 ACSL4 的铁死亡途径对 p53 介导的肿瘤抑制作用非常重要。ALOX12 基因位于人类染色体 17p13.1,这是人类癌症中单等位基因缺失的热门位点。 该团队首先验证了 ALOX12 对于 ROS 应激下 p53 介导的铁死亡是必不可少的。他们发现 ALOX12 耗竭对 p53 水平或其转录靶标 (例如 SLC7A11、Mdm2 和 p21) 的表达没有明显影响,但可以挽救 p53 介导的铁死亡 (图 6a-b)。 随后,他们发现在 ROS 应激下 p53 介导的铁死亡独立于 GPX4 调节。如图 6c,在 GPX4 敲除细胞中可以检测到高水平的内源性脂质过氧化,而 GPX4 异位表达后,脂质过氧化水平显着降低。同时,RSL-3 (GPX4 抑制剂) 可以抑制 GPX4 对脂质过氧化的减少作用,而 p53 的激活对其没有任何影响。 接着,作者团队研究 ALOX12 对于 p53 介导的肿瘤生长抑制的影响。研究发现,四环素诱导的 p533KR 表达会显着降低肿瘤细胞的生长;而 ALOX12 基因敲除会大大的抑制 p533KR 的肿瘤抑制作用。这表明 ALOX12 对 p53 的肿瘤细胞生长抑制活性至关重要。 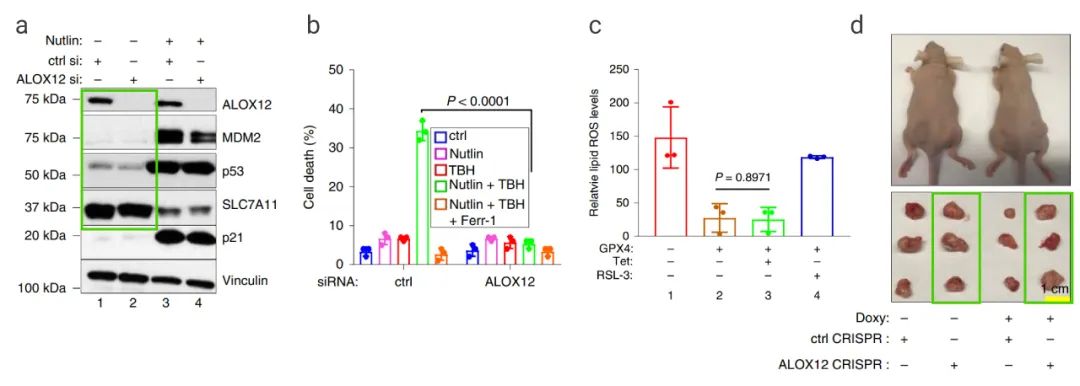
图 6. ALOX12 在 ROS 应激下 p53 介导的铁死亡中的作用[15] a: U2OS 细胞的蛋白质印迹分析;b: 不同药物处理 U2OS 细胞死亡情况;c: 细胞脂质过氧化水平的变化;d: H1299 Tet-on p533KR 和 ALOX12 敲除鼠的异种移植肿瘤情况。 ■ iPLA2β 是 p53 介导的铁死亡途径的关键调节因子今年 6 月,该团队又在 Nature Communications 上发表了“iPLA2β-mediated lipid detoxification controls p53-driven ferroptosis independent of GPX4”,再次指出 iPLA2β 是在高 ROS 应激条件下 p53 激活诱导的铁死亡的关键调节因子。同时,p53 以不依赖 GPX4 的方式诱导铁死亡。
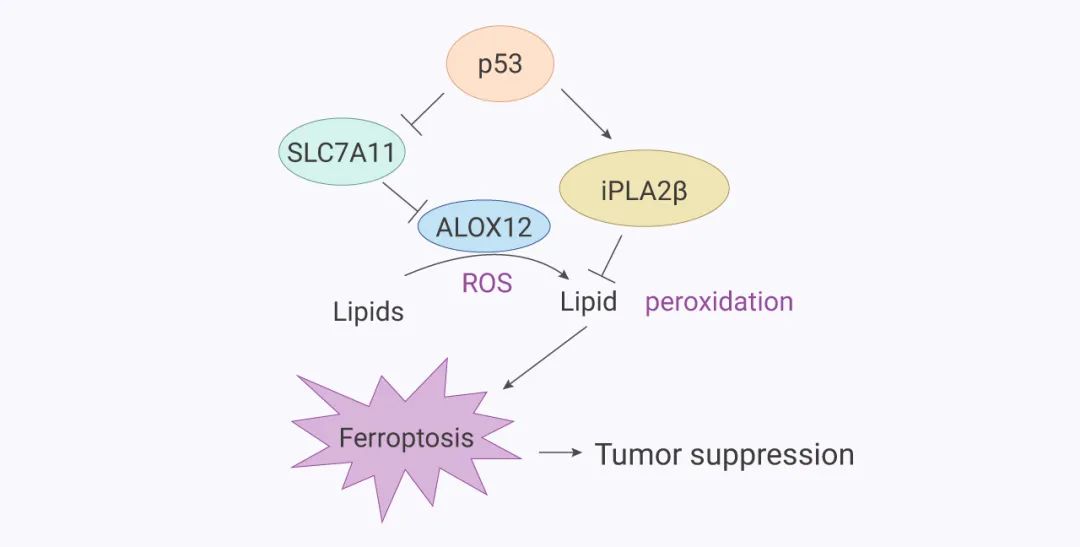
图 7. ALOX12 和 iPLA2β 在调节 p53 介导的铁死亡中的作用模型[16]
作者团队发现 p53 以不依赖 GPX4 方式介导铁死亡。 他们首先在 ACSL4/GPX4 双基因敲除 (ACSL4-/-/GPX4-/-) 的人骨肉瘤细胞系 U2OS 中发现: p53 水平不受 ACSL4 和 GPX4 的影响,同时 p53 介导的 p21 转录激活或 SLC7A11 的抑制也基本没有变化 (图 8a)。然而,当 ACSL4-/-/GPX4-/- 细胞暴露于TBH 和 Nutlin 时,我们很容易能观察到细胞铁死亡,并且可以被铁死亡抑制剂,特异性阻断 (图 8b)。 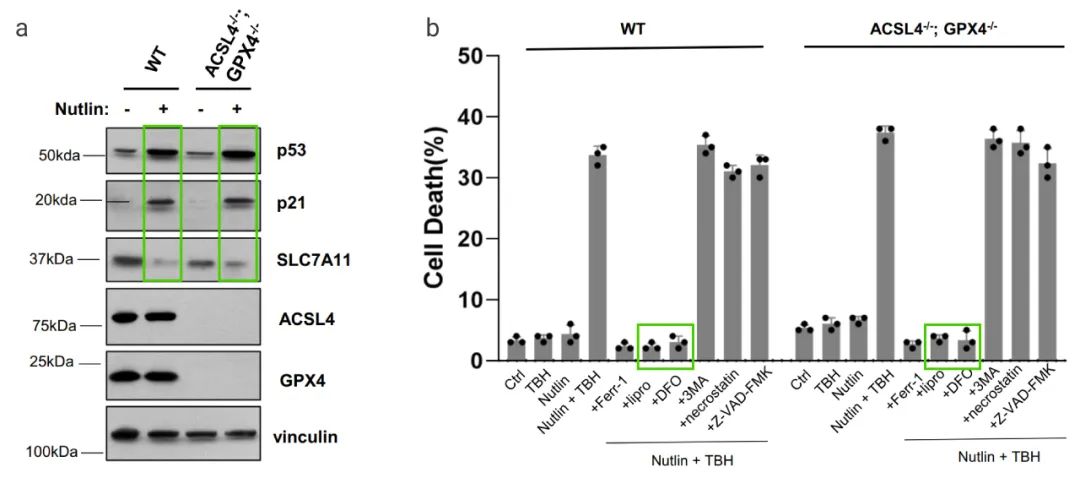
图 8. 在 ROS 刺激下 p53 以不依赖 GPX4 方式介导铁死亡[16]
总结:
抑癌基因 p53,在肿瘤领域的热度,绝对是处于一梯队的。铁死亡是一种新型的调节性细胞死亡形式,自被发现就引起了研究狂潮,热度不减。
p53 与铁死亡结合的研究发现,拓展了 p53 新的调控肿瘤发展的机制,也为研究出肿瘤抑制作用的新型药物开辟了新的方向。虽前路漫漫,但未来可期!
| 相关产品 |
| Nutlin-3a 一种有效的 MDM2 抑制剂;可抑制 MDM2-p53 相互作用,稳定 p53 蛋白,从而诱导细胞自噬和凋亡。 |
| Nutlin-3 一种有效的 p53-MDM2 抑制剂,Ki 为 90 nM。 |
| Idasanutlin 一种有效,选择性的 MDM2 拮抗剂,能够抑制 p53-MDM2 的结合,IC50 值为 6 nM。 |
| Pifithrin-α hydrobromide 一种 p53 抑制剂,可阻断其转录活性并阻止细胞凋亡;一种 aryl hydrocarbon receptor (AhR) 的激动剂。 |
| Erastin 铁死亡诱导剂;结合且抑制电压依赖性阴离子通道 (VDAC2/VDAC3)。 |
| RSL3 谷胱甘肽过氧化物酶 4 (GPX4) 的抑制剂 (ferroptosis 激动剂),可降低 GPX4 的表达。 |
| Ferrostatin-1 选择性的 ferroptosis 抑制剂;抗氧化剂。 |
MCE 的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务。
下滑查看更多 ↓
1. Elie Dolgin, et al. The most popular genes in the human genome. Nature. 2017 Nov 23;551(7681):427-431. 2. Gaurav Mendiratta, et al. Cancer gene mutation frequencies for the U.S. population. Nat Commun. 2021 Oct 13;12(1):5961. 3. Liz J Hernández Borrero 1, Wafik S El-Deiry, et al. Tumor suppressor p53: Biology, signaling pathways, and therapeutic targeting. Biochim Biophys Acta Rev Cancer. 2021 Aug;1876(1):188556. 4. Sandra L Harris, et al. The p53 pathway: positive and negative feedback loops. Oncogene. 2005 Apr 18;24(17):2899-908. 5. David Lane, Arnold Levine, et al. p53 Research: the past thirty years and the next thirty years. Cold Spring Harb Perspect Biol. 2010 Dec;2(12):a000893. 6. Arjelle Decasa Agupitan, Ygal Haupt, et al. P53: A Guardian of Immunity Becomes Its Saboteur through Mutation. Int J Mol Sci. 2020 May 13;21(10):3452. 7. N S Litofsky, L D Recht, et al. The impact of p53 tumor suppressor gene on glioma biology. 8. Jiandong Chen, et al. The Cell-Cycle Arrest and Apoptotic Functions of p53 in Tumor Initiation and Progression. Cold Spring Harb Perspect Med. 2016 Mar 1;6(3):a026104. 9. Alexei Vazquez, Gareth L Bond, et al. The genetics of the p53 pathway, apoptosis and cancer therapy. Nat Rev Drug Discov. 2008 Dec;7(12):979-87. 10. Y Xie, R Kang, D Tang et al. Ferroptosis: process and function. Cell Death Differ. 2016 Mar;23(3):369-79. 11. Patrick Chène, et al. Inhibiting the p53-MDM2 interaction: an important target for cancer therapy. Nat Rev Cancer. 2003 Feb;3(2):102-9. 12. Wen Xue, et al. Senescence and tumour clearance is triggered by p53 restoration in murine liver carcinomas. Nature. 2007 Feb 8;445(7128):656-60. 13. Xiaolei Zhou, Galina Selivanova, et al. Pharmacological activation of p53 triggers viral mimicry response thereby abolishing tumor immune evasion and promoting anti-tumor immunity. Cancer Discov. 2021 Jul 6;candisc.1741.2020. 14. Le Jiang, Wei Gu, et al. Ferroptosis as a p53-mediated activity during tumour suppression. Nature. 2015 Apr 2;520(7545):57-62. 15. Bo Chu, Wei Gu, et al. ALOX12 is required for p53-mediated tumour suppression through a distinct ferroptosis pathway. Nat Cell Biol. 2019 May;21(5):579-591.16. Delin Chen, Wei Gu, et al. iPLA2β-mediated lipid detoxification controls p53-driven ferroptosis independent of GPX4. Nat Commun. 2021 Jun 15;12(1):3644.