企业档案
会员类型:会员

已获得易推广信誉 等级评定
171成长值
(0 -40)基础信誉积累,可浏览访问
(41-90)良好信誉积累,可接洽商谈
(91+ )优质信誉积累,可持续信赖
易推广会员:8年
最后认证时间:
注册号: 【已认证】
法人代表: 【已认证】
企业类型:生产商 【已认证】
注册资金:人民币万 【已认证】
产品数:91228
参观次数:11302606
公司新闻
G 蛋白偶联受体与小分子化合物的相互作用 | MedChemExpress
点击次数:1356发布时间:2021/9/15
化学遗传学 (Chemogenetics) 是指一种蛋白被改造与先前未被识别的小分子化合物相互作用的过程。多种蛋白的改造已被报道,包括激酶、非激酶的酶类、G 蛋白偶联受体 (GPCRs) 和配体门控离子通道。化学遗传学技术 DREADDs (Designer receptors exclusively activated by designer drugs) 被广泛应用于神经科学中,并被称为通过 G 蛋白信号通路选择性操作细胞活力的生物学“锁和钥匙” (Lock-and-key) 系统。
G 蛋白偶联受体
G 蛋白偶联受体 (G-protein-coupled receptors, GPCRs) 是人类基因组中的蛋白质超家族。GPCRs 是一大类七次跨膜的受体蛋白,通过与 G 蛋白偶联,随后调节多种细胞内信号级联反应,以响应激素、神经递质、离子、光、气味、趋化因子和其他刺激 ,参与了众多生理过程包括感光、嗅觉、行为和情绪的调节、自主神经系统的调节、免疫系统的调节等。GPCRs 在生理学和疾病中扮演着重要的角色,是非常有吸引力的药物靶点。经典的 GPCR 信号转导依赖于受体介导的异源三聚体 G 蛋白的激活。异源三聚体 G 蛋白由 Gα、Gβ 和 Gγ 三个亚基组成,其中 Gα 亚基可以与鸟苷二磷酸 (GDP) 结合,具有 GTP 水解酶活性。当 G 蛋白处于非活化态时,为异三聚体,Gα 亚基与 GDP 结合。经典 GPCR 通路活化:
不同类型的 GPCRs 与细胞外各种配体 (胞外信使) 结合从而接受外界的信号刺激,然后 GPCRs 被活化。→ → GPCRs 与 G 蛋白结合形成复合体,G 蛋白 Gα 亚基构象发生改变并排斥 GDP,转而结合 GTP,G 蛋白活化。
→ → G 蛋白再激活其下游的各种效应器,产生细胞内的第二信使,如环磷酸腺苷 (cAMP)、环鸟苷酸 (cGMP)、肌醇三磷酸 (IP3)、磷脂酰肌醇-4,5-二磷酸 (PIP2)、Ca2+ 和 NO 等,从而将信号逐级传递下去,*终细胞响应各类刺激产生不同的兴奋性变化。
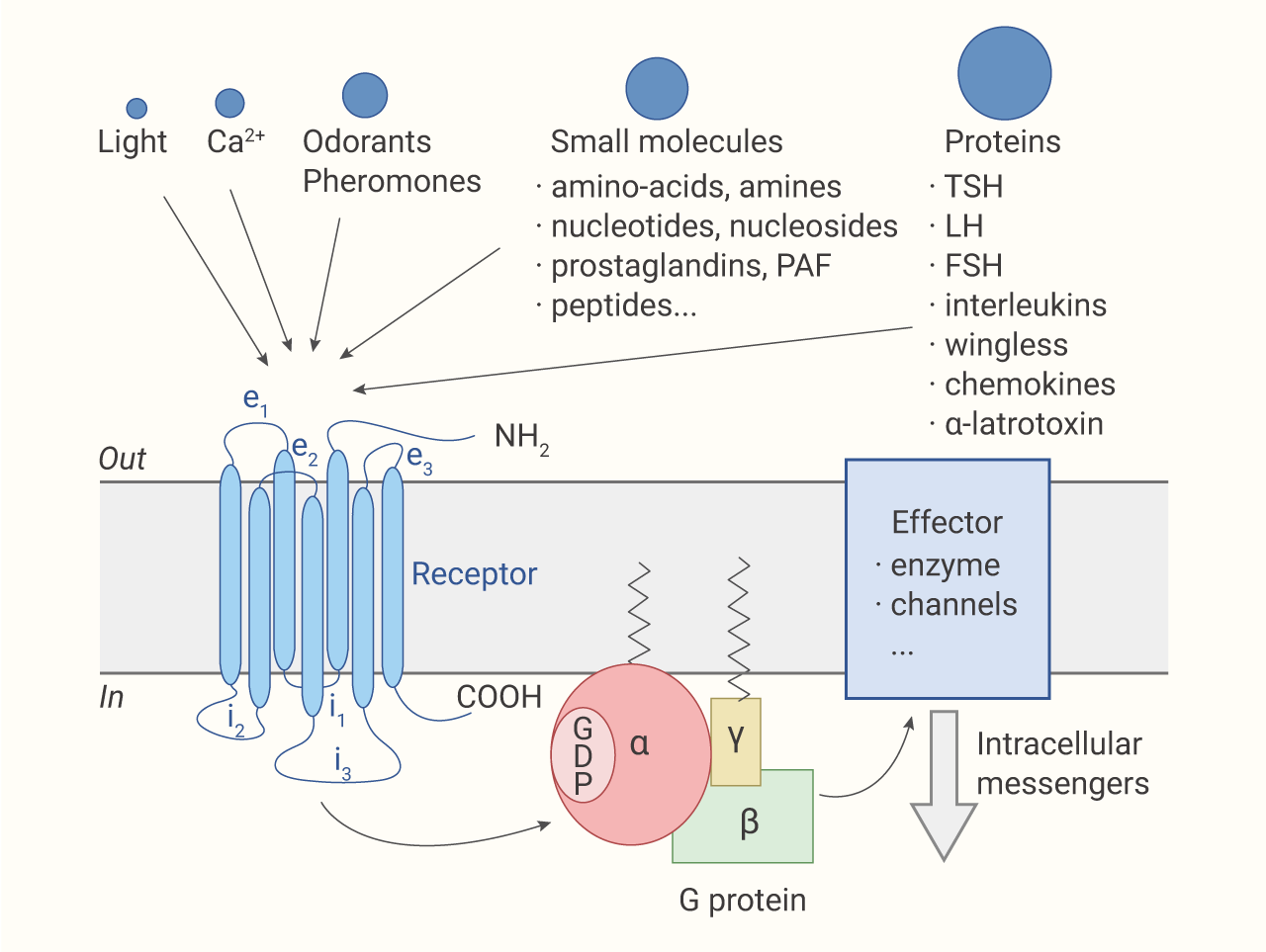
图 1. G 蛋白偶联受体的模式图[10]
非经典的 GPCR 信号转导依赖于小 G 蛋白 (Small G proteins) 的激活,小 G 蛋白通常是由大约 200 个氨基酸组成的单一多肽,同样具有 GTP 水解酶活性。
GPCRs 广泛分布于各个组织器官,其内源性和外源性配体、细胞功的多样性,以及 G 蛋白家族的复杂多样,都使得体内特定 GPCR 信号通路的探究之路困难重重。DREADDs 这时候就出场啦~
DREADDs 技术的降生
1991 年,Strader 等人首次尝试改造 GPCRs,然后使用外源性的人工合成配体激活改造后的 GPCRs,激活特定的 GPCR 信号通路。可惜的是,他们使用的合成配体的效力太低,无法用于进一步的体内研究。1998 年,Coward 等人创造了一种突变的 KOR,并命名为 Ro1 和 Ro2,Ro1 和 Ro2 对天然的 Opioid peptides 配体不敏感,但对合成的KOR激动剂有反应。此后,更多的 GPCRs 被改造,成功的应用于特定的 GPCR 信号通路的体内研究。被改造的 GPCRs 称为 RASSLs,这一方法则被称为 RASSLs 技术,可以作为简化 GPCR 信号通路复杂性的工具。不过 RASSLs 技术仍然存在一些局限:
1. 其配体对天然受体具有明显的亲和力和效力 (非选择性活性),限制了RASSLs在体内的应用;2. 缺少体内高效力配体;3. 合成配体可能与其他蛋白靶点有亲和力;4. 许多 RASSLs 受体在体内有高基础信号,会掩盖合成配体诱导的表型。
Pei Y 等人在 2008 年正式提出了使用 DREADDs 技术克服 RASSLs 技术的局限性。DREADDs 与 RASSLs 技术原理相同,两者都是将不同的 GPCRs 进行改造,使改造后 GPCRs 只接受外源性的人工合成配体的信号,并激活相应的 GPCR 信号通路,从而引发细胞不同的变化。RASSLs 受体大多是单突变体,对于一些天然配体仍然有反应,DREADDs 则对天然配体无反应。
常见的 DREADDs 受体包括 hM3Dq 、hM4Di 和 GsD (引起 Gs 相关信号通路激活) 均是双位点突变,对天然配体无反应,这降低了体内基础信号产生的几率。
PS:此前 Blaine N. Armbruster 等人鉴定出人毒蕈碱乙酰胆碱受体 (mAChR) 3 亚型的双突变体 (Y149C3.33/A239G5.46),即 hM3Dq,以及 4 亚型的双突变体 (Y149C3.33/A239G5.46),即 hM4Di。hM3Dq 和 hM4Di 对天然配体乙酰胆碱 (Ach) 无反应,但是可以被小分子叠氮平-N-氧化物 (CNO) 激活。hM3Dq 被 CNO 激活时引起 Gαq 相关信号通路的激活,hM4Di 被 CNO 激活时能有效抑制 cAMP 的产生,激活 Gi 相关信号通路。
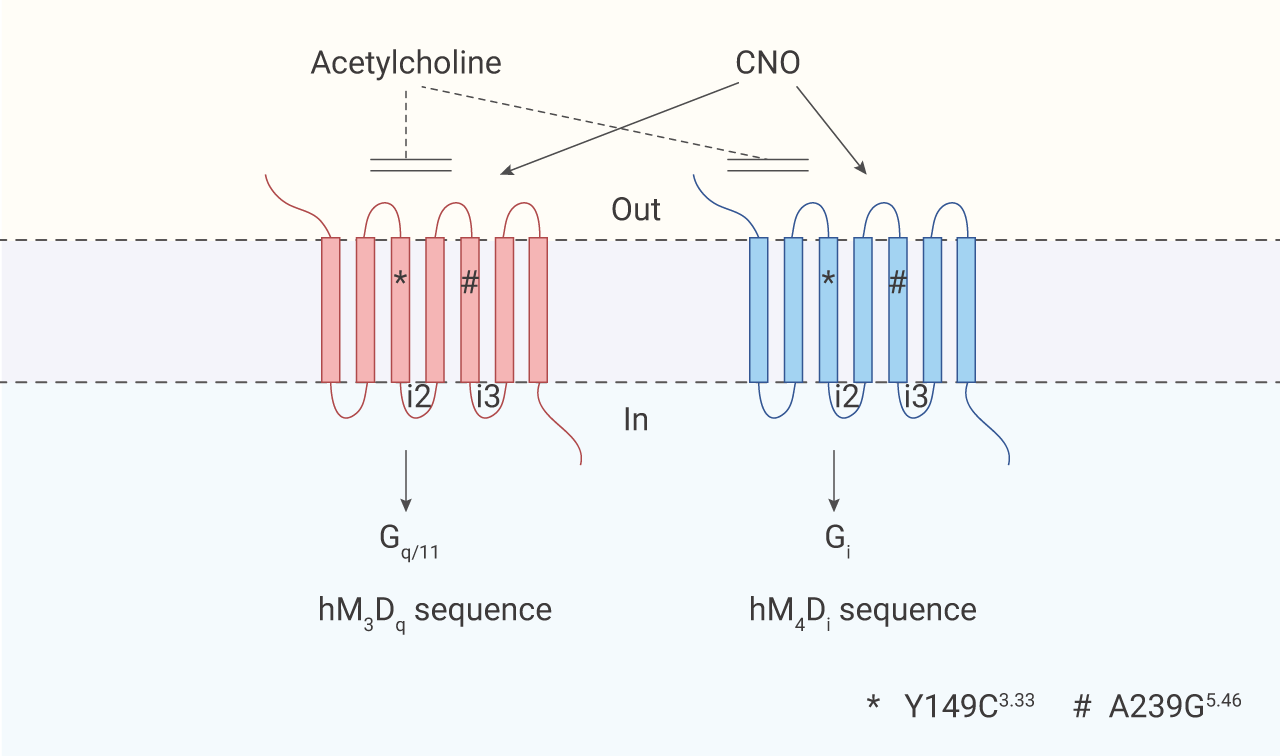
图 2. hM3Dq 和 hM4Di 受体结构示意图
CNO 与 DREADDs 受体的亲和力也更高,可以作为高效配体在各类动物体内广泛应用。此外,CNO 具有类似药物的特性,但在药理学上是惰性的,缺乏明显的脱靶作用,这也减少了合成配体与其他蛋白质靶点结合的可能性。
DREADDs 技术的现状
目前,DREADDs 技术广泛用于神经元的相关研究,操作步骤可以概括如下:1、选定并改造合适的 DREADDs 受体;
2、通过转基因动物或病毒载体,将 DREADDs 受体基因导入动物体内。目前已开发出携带 DREADDs 受体转基因的重组腺相关病毒 (AAV) 载体,通过添加细胞特异性启动子,配合立体定位注射的方法,实现 DREADD 受体基因在不同组织细胞内的精准表达。如果使用 Cre-Lox P 的条件性基因敲除动物可进一步实现基因的条件可控性表达;
3、对动物进行 CNO 给药 (控制时间或剂量);
4、DREADDs 受体的有效性的检测和动物表型检测。
尽管 DREADDs 技术早已成为研究动物神经元调节的强有力工具,但由于 CNO 具有较差的脑外显率,并且通过代谢降解会产生抗精神病药物氯氮平 (Clozapine),这些特性限制了 DREADDs 技术在临床医学上应用。随着新技术的不断涌现,将 DREADDs 技术和正电子发射计算机断层显像技术 (PET) 结合,使 DREADDs 技术在更为广泛的平台使用成为现实。
2019 年,美国国立药物滥用研究所 Jordi Bonaventura 等人的一项研究首次将 PET 技术与 DREADDs 技术相结合。研究团队开发出了 3 种新型的 DREADDs 配体 JHU37152、JHU37160 和 [18F]JHU37107。这几种配体都是 DREADDs 受体的强激动剂,具有出色的大脑渗透能力,并且不会转化为氯氮平,其中,[18F]JHU37107 放射化学结构*为稳定,可以用作特异性的 PET 放射性示踪剂,在小鼠、大鼠和恒河猴体内对局部定位的神经元及其远程投射成功地进行了 DREADDs 检测,从而实现无创性神经元投射标测。DREADDs 技术和 PET 成像技术结合的关键在于开发新型高效的且有稳定放射化学结构的 DREADDs 配体。

图 3. PET 放射性配体 [18F]JHU37107 在局部靶向 DREADDs 作用[11]
a. [18F]JHU37107 的结构;b. [18F]JHU37107 与转基因 D1-DREADD 小鼠大脑中的 DREADDs 结合;c. [18F]JHU37107 与大鼠皮层中表达的 AAV-DREADDs 结合;d. [18F]JHU37107 与猴子杏仁核中表达的 hM4Di 结合。
a. [18F]JHU37107 的结构;b. [18F]JHU37107 与转基因 D1-DREADD 小鼠大脑中的 DREADDs 结合;c. [18F]JHU37107 与大鼠皮层中表达的 AAV-DREADDs 结合;d. [18F]JHU37107 与猴子杏仁核中表达的 hM4Di 结合。
总结:GPCRs 参与复杂多样的细胞信号传导,是目前*有潜力的药物靶点。然而,GPCRs 的复杂性和多样性给这些受体的研究带来了极大的挑战。DREADDs 技术的出现为人工控制 GPCR 介导的信号转导和揭示特定生理事件背后的机制提供了强有力的工具。近年,DREADDs 技术与 PET 技术的结合更是扩大了该技术的适用范围。相信未来 DREADDs 技术还会在更多领域发挥作用。
| 相关产品 |
| Cyclic AMP 细胞内的第二信使,由于某些激素或其它分子信号刺激激活腺苷酸环化酶。 |
| Clozapine-N-oxide DREADDs 受体的配体,可以激活 DREADD 受体 hM3Dq 和 hM4Di。 |
| Clozapine 毒蕈碱乙酰胆碱受体 M1 受体的拮抗剂和 M4 受体的激动剂,可用于抗精神分裂症的研究。 |
| Acetylcholine chloride 一种神经递质,通过刺激 nAChRs,调节神经元的活性。 |
| GPCR/G 蛋白化合物库 收录了 1400+ 种靶向 GPCRs 的小分子化合物,可以用于 GPCR 相关的不同研究及药物开发筛选。 |
| 神经信号化合物库 收录了 1400+ 种神经信号相关的小分子化合物,可以用于研究神经调控及神经疾病。 |
缩写
Κ opioid receptor, KOR
RASSLs: Receptors activated solely by synthetic ligands
mAChR: Human muscarinic acetylcholine receptor
Ach: Acetylcholine
CNO: Clozapine-N-oxide
PET: Positron Emission Computed Tomography
参考文献
1. Hilger D, Masureel M, Kobilka BK. Structure and dynamics of GPCR signaling complexes. Nat Struct Mol Biol. 2018 Jan;25(1):4-12.
2. Simon MI, Strathmann MP, Gautam N. Diversity of G proteins in signal transduction. Science. 1991 May 10;252(5007):802-8.
3. Hermans E. Biochemical and pharmacological control of the multiplicity of coupling at G-protein-coupled receptors. Pharmacol Ther. 2003 Jul;99(1):25-44.
4. Strader CD, Gaffney T, Sugg EE, Candelore MR, Keys R. et al. Allele-specific activation of genetically engineered receptors. J Biol Chem 266: 5–8, 1991.
5. Coward P, Wada HG, Falk MS, Chan SD.et al. Controlling signaling with a specifically designed Gi-coupled receptor. Proc Natl Acad Sci USA 95: 352–357, 1998.
6. Sweger EJ, Casper KB, Scearce-Levie K, Conklin BR, McCarthy KD. Development of hydrocephalus in mice expressing the G(i)-coupled GPCR Ro1 RASSL receptor in astrocytes. J Neurosci 27:2309–2317, 2007.
7. Pei Y, Rogan SC, Yan F, Roth BL. Engineered GPCRs as tools to modulate signal transduction. Physiology (Bethesda). 2008 Dec;23:313-21.
8. Armbruster BN, Li X, Pausch MH, Herlitze S, Roth BL. Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. Proc Natl Acad Sci U S A. 2007 Mar 20;104(12):5163-8.
9. Ardizzone TD, Bradley RJ, Freeman AM 3rd, Dwyer DS. Inhibition of glucose transport in PC12 cells by the atypical antipsychotic drugs risperidone and clozapine, and structural analogs of clozapine. Brain Res. 2001 Dec 27;923(1-2):82-90.
10. Bockaert J, Pin JP. Molecular tinkering of G protein-coupled receptors: an evolutionary success. EMBO J. 1999 Apr 1;18(7):1723-9.
11. Bonaventura J, Eldridge MAG, Hu F, Gomez JL, Sanchez-Soto M, Abramyan AM. et al. High-potency ligands for DREADD imaging and activation in rodents and monkeys. Nat Commun. 2019 Oct 11;10(1):4627