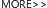企业档案
会员类型:会员

已获得易推广信誉 等级评定
(0 -40)基础信誉积累,可浏览访问
(41-90)良好信誉积累,可接洽商谈
(91+ )优质信誉积累,可持续信赖
易推广会员:8年
最后认证时间:
注册号: 【已认证】
法人代表: 【已认证】
企业类型:生产商 【已认证】
注册资金:人民币万 【已认证】
产品数:91228
参观次数:11303607
公司新闻
神经干细胞移植 “逆转” 神经损伤 - MedChemExpress
点击次数:341发布时间:2022/11/29
神经退行性疾病是影响全球数百万人的高度致残且*终致命的疾病,主要包括肌萎缩侧索硬化症 (Amyotrophic lateral sclerosis, ALS)、帕金森病 (Parkinson's disease, PD)、阿尔茨海默症 (Alzheimer's disease, AD) 和亨廷顿病 (Huntington's disease, HD)。在神经退行性疾病中,特定的神经元亚群,例如多巴胺能和胆碱能神经元或运动神经元会逐渐退化,导致特定模式的神经系统功能障碍。传统药物治疗用于延缓疾病进展,不能使功能修复或组织再生[1]。
神经干细胞 (Neural stem cells, NSCs) 在神经系统的可塑性、衰老、疾病和再生方面具有重要作用。基于体内移植的 NSCs 具有自我更新、增殖、多向分化、低免疫原性和迁移的特点,NSCs 移植的成为了极具前景的一种神经系统疾病疗法,为脑损伤修复以及神经性疾病的治疗带来了希望。
神经干细胞 (NSCs) 被喻为中枢神经系统 (CNS) 的 “种子” 细胞,不同神经细胞系的产生起源于成体神经干细胞。神经干细胞命运的调控更是一个精细的过程,依赖于从表观遗传延伸到翻译水平的复杂调控网络,且涉及细胞外基质成分[2]。
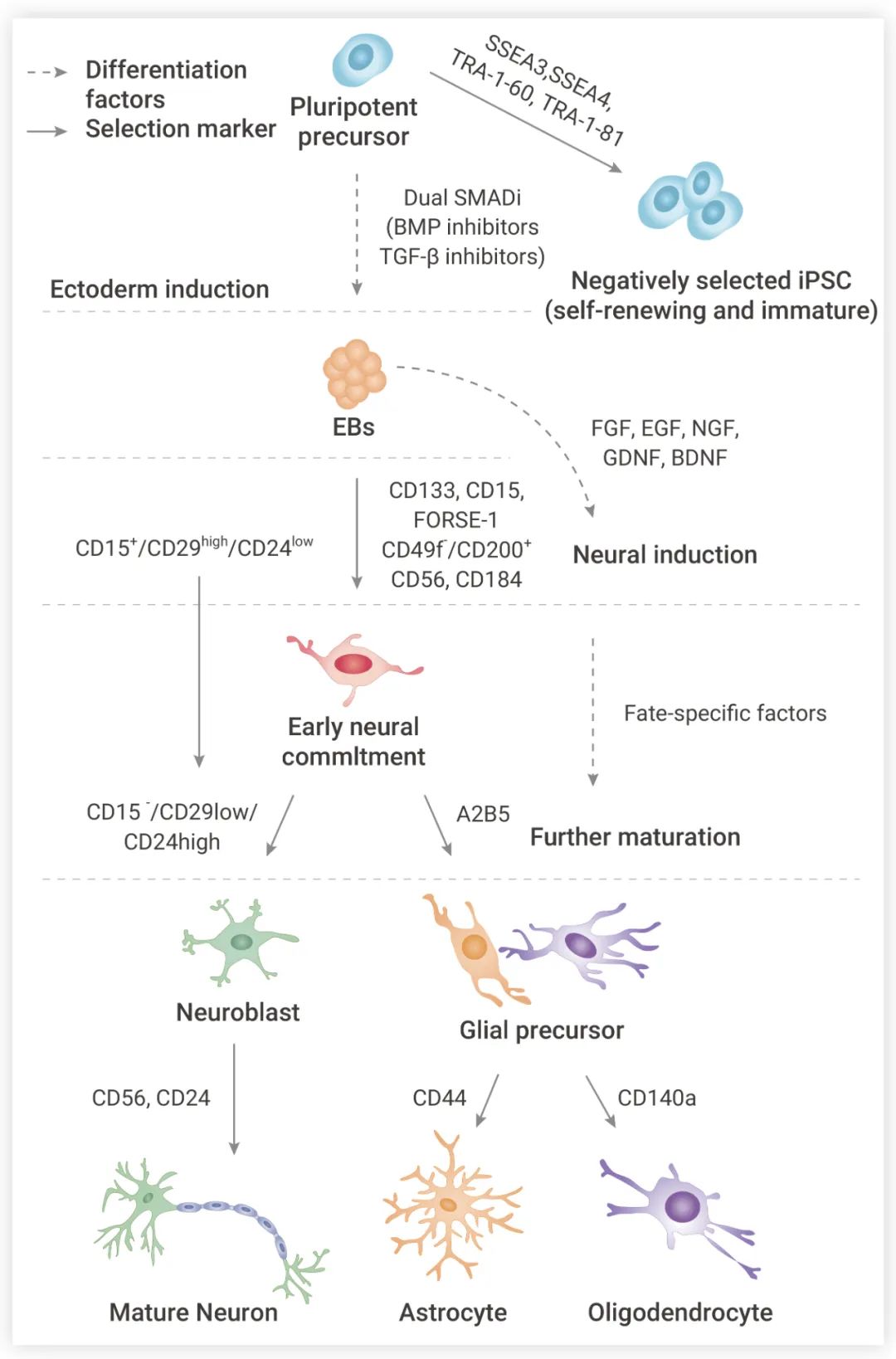
成体 NSCs 可以自我更新或响应特定刺激分化为神经元、星形胶质细胞或少突胶质细胞 (图 1),不同谱系的神经细胞功能各异。
星形胶质细胞 (Astrocytes) 是中枢神经系统 (CNS) 中*丰富的细胞类型,它们与神经元、少突胶质细胞和内皮细胞交流,并在结构上支持它们生长,整合为三联突触和神经血管单位,履行其功能。除了参与细胞通讯外,星形胶质细胞还能通过释放神经营养因子,如胶质细胞系衍生的神经营养因子 (GDNF),以及降低神经元的兴奋中毒,发挥神经保护作用。
少突胶质细胞 (Oligodendrocytes, OLGs) 是有髓鞘的胶质细胞,对神经元电绝缘、促进跳跃信号传导非常重要。少突胶质细胞还通过髓磷脂膜为神经元轴突提供代谢和营养支持,包括乳酸、丙酮酸和脑源性神经营养因子 (BDNF) 等神经营养因子。
如何有效地将 NSCs 诱导成特定的细胞类型? 神经营养因子、生长因子参与了 NSCs 增殖和分化的内源性调控,已被证明能诱导 NSCs 分化。目前已经开发了不同的 NSCs 分化方案。大多数都是基于含有生长因子的培养基,NSCs 在其中粘附和增殖。这些生长因子包括成纤维细胞生长因子 (FGF) 和/或表皮生长因子 (EGF)、神经生长因子 (NGF)、脑源性神经营养因子 (BDNF) 和胶质源性神经营养因子 (GDNF) 等。
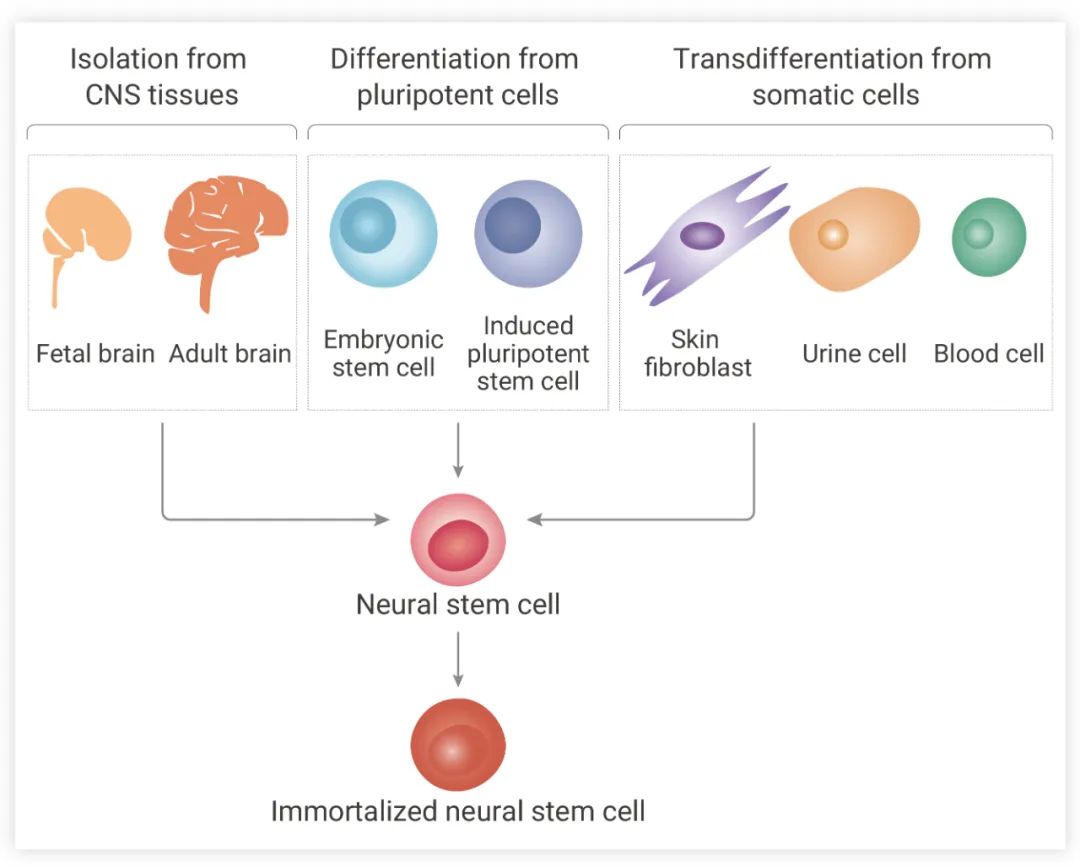
如在下文中,作者团队发表了一种快速、高效的分化方法,通过使用含有必要生长因子的选择性培养基从骨髓来源的细胞中生成小鼠 OLGs。通过该方案,可以在 7-8 周内获得成熟的 OLGs (与以前的工作相比,获得 OLGs 的时间更短)。
作者团队的方法主要包括三个步骤: 骨髓来源的 NSCs 生成、NSCs-OPCs 分化和 OLGs 成熟[4]。
骨髓来源的 NSCs 生成:收集骨髓组织切小块,消化,将细胞悬浮在无血清 DMEM/F12 中,添加 2% B27 补充剂, 20 ng/mL EGF 和 10 ng/mL bFGF ,同时添加 100 IU/mL 青霉素和 100 μg/mL 链霉素。随后将细胞悬浮在 NSC-PM (神经干细胞增殖培养基)中,并包裹于含聚 D-赖氨酸和层粘连蛋白的 24 孔板。10-14 天后,形成类似神经球的细胞团簇。
骨髓来源的 NSCs-OPCs 的分化和增殖:形成的神经球被消化到单细胞中,在 NSC-PM 中培养。每个孔中的神经球被消化成单细胞,在特定的 NSCs 分化培养基中培养。
OLGs 成熟:在 OLGs 成熟过程中,用 DPBS 缓冲液洗去生长因子 (PDGF-AA 和 bFGF),加入新鲜 EOLG-DM (早期 OLGs 分化培养基) 诱导 OLGs 分化,然后将在EOLG-DM 培养基中生长 4 天的 OPCs 转移到 LOLG-DM (晚期 OLGs 分化培养基) 中再生长 10 天,并通过添加 cAMP 加速 OLGs 分化的分支生长。
图 3. 从小鼠自体骨髓来源的 NSCs 中生成少突细胞祖细胞 (OPCs) 和少突胶质细胞[4]
此外,越来越多的科研人员关注多种神经营养因子/细胞因子联合使用。Kyung-Chul Choi 教授团队证明了生长因子的组合使用 (bFGF+IGF-I、bFGF+NGF、bFGF+BDNF、BDNF+IGF-I、bFGF+NGF) 对 NSCs 分化为神经元的效果比单个生长因子 (bFGF、IGF-I、BDNF 和 NGF) 处理结果更显著[5]。
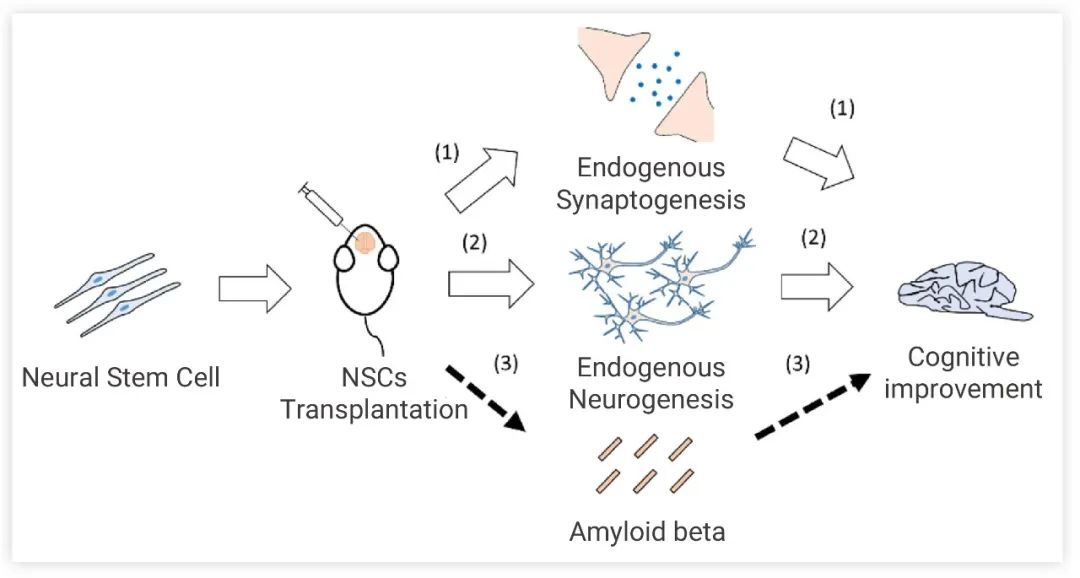 图 4. NSCs 移植途径及认知障碍修复机制:触发内源性突触形成、内源性神经形成影响行为表现、调节 Aβ 聚集[6]
图 4. NSCs 移植途径及认知障碍修复机制:触发内源性突触形成、内源性神经形成影响行为表现、调节 Aβ 聚集[6]
接下来小 M 来介绍一个在 APPswe/PS1dE9 双转基因小鼠中移植 NSCs 治疗 AD 的例子~
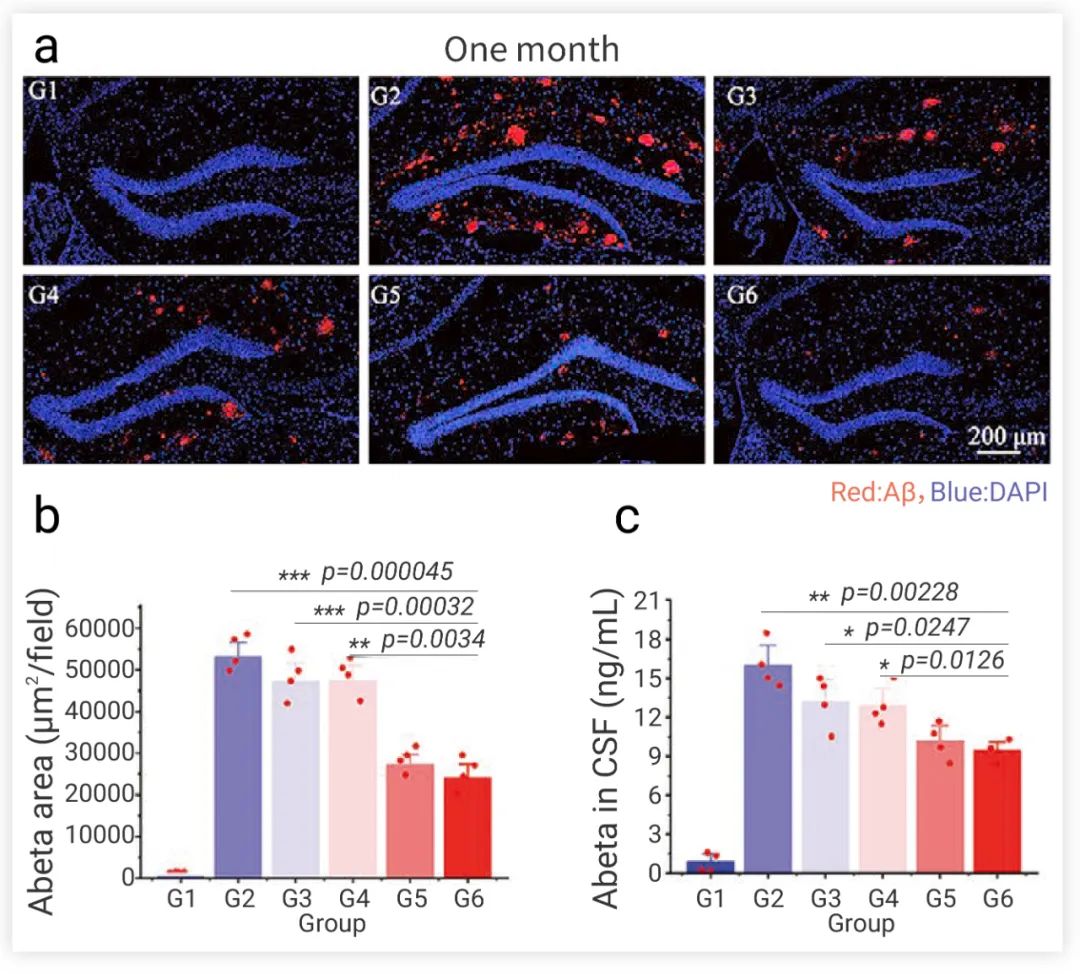
图 5. NSCs 移植治疗后 AD 小鼠大脑中 Aβ 定量检测。G1:健康小鼠;G2:PBS 处理组;G3:NSC 治疗组;G4:纳米制剂-NSC 治疗组;G5:NEP–NSC 治疗组;G6:纳米制剂-NEP-NSC 治疗组[7]
17038899, 27213850, 25022790, 18683244, 27562609, 25132189
| 相关产品 |
| 一种有效的有丝分裂因子,通过与细胞表面受体——表皮生长因子受体 (EGFR/ErbB) 的高亲和力结合发挥作用。EGF 在众多类型细胞的生长、增殖和分化中发挥着重要作用,常用于 NSCs 的增殖培养。 |
| 一种内皮细胞和成纤维细胞的有效有丝分裂原,有广泛的生物学功能,包括有丝分裂发生、细胞存活、转移形成,常用于 NSCs 的培养,bFGF 诱导神经干细胞增殖。 |
| NGF 是神经营养因子中发现*早的因子,迄今为止研究*彻底,具有提供神经元营养和促进突触生长的双重生物学功能。 |
| 一种神经营养因子,能够与 TrkB 受体结合,调节神经发育过程,包括神经元的存活,分化,及突触可塑性。BDNF 能刺激 NSCs 增殖,显着增加 NSCs 向神经元和少突胶质细胞的分化。 |
| 神经营养因子家族中的一员,能够与两种不同受体结合,高亲和性受体 TrkB 和低亲和性受体 p75NTR。 |
| 在神经系统中广泛表达。NT-3 能促进 BM-NSCs 增殖和分化为胆碱能神经元,并增加上清液中乙酰胆碱 (ACh) 的水平。 |
| 一种多能性神经营养因子,高浓度的CNTF通过 JAK-STAT 信号通路作用,将细胞分化为星形胶质细胞。低浓度 CNTF 作为另一种神经元诱导剂。这种诱导剂属于造血细胞因子超家族,通过与 CNTF 受体 α (CNTFRα) 和 gp130 结合发挥作用,*终募集白血病抑制因子受体 β (LIFRβ) 并激活丝裂原活化蛋白激酶通路。 |
| 一种有效的促有丝分裂因子 (有丝分裂原),能调节结缔组织和发育中神经系统的细胞生长和分裂。甲状腺激素 (T3) 和血小板衍生生长因子 (PDGF) 的组合通过 Wnt/β 促进少突胶质细胞的分化-连环蛋白信号通路。 |
| Hedgehog 家族分泌信号蛋白的一员,在成体干细胞增殖中起作用。SHH 是细胞增殖、神经发生和神经元成熟的正向调节剂[17]。 |
| IGF-I 在大脑发育过程中表达,被认为作用于所有神经细胞。IGF-I 是调节 NSCs 活化的关键。 |
| 诱导神经前体细胞 (iNPCs) 衍生多巴胺能神经元 (DA) 生成的关键因子。 |
| 一种神经营养因子,能促进中脑多巴胺能神经元的存活分化,支持人多能干细胞来源的神经祖细胞向神经元分化。 |
| 用于染色细胞核。 |
参考文献
下滑查看更多↓