产品展示
优质供应
详细内容
类器官培养系统--- HUMIMIC
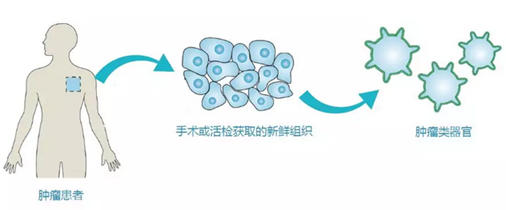
类器官是指在结构和功能上都类似来源器官或组织的模拟物,通过取特定器官的干细胞(iPS/ES),或者利用人的干细胞定向诱导分化,能获得微型的器官样的三维培养物,在体外模拟人体器官发育过程。
类器官,具有某一器官多种功能性细胞和组织形态结构的三维(3D)培养物,主要来源于人具有多项分化潜能的干细胞(包括人胚胎干细胞和人诱导干细胞iPSCs)或成体干细胞。人干细胞能分化为个体所有类型的细胞,在体外,经过诱导分化,模拟人体器官发育过程,能使人干细胞直接分化形成各种类器官;不同组织器官都存在内源组织干细胞,在维持各器官的功能形态发挥着重要作用。这些干细胞在体外一定的诱导条件下,可以自组织形成一个直径仅为几毫米的具有组织结构和多种功能细胞的三维培养物。器官芯片是获取两个或两个以上不同的类器官,并且放置在特定的培养芯片上进行共培养,能模拟人体的多个器官参与的生理学过程。
与传统2D细胞培养模式相比,3D培养的类器官包含多种细胞类型,能够形成具有功能的“微器官”,能更好地用于模拟器官组织的发生过程及生理病理状态,因而在基础研究以及临床诊疗方面具有广阔的应用前景。
基于这一定义,可以发现类器官具备这样几个特征:
? 必须包含一种以上与来源器官相同的细胞类型;
? 应该表现出来源器官所特有的一些功能;
? 细胞的组织方式应当与来源器官相似。
类器官作为一个新兴的技术,在科学研究领域潜力巨大,包括发育生物学、疾病病理学、细胞生物学、再生机制、医疗以及药物毒性和药效试验。类器官培养使研究人体发育提供了不受伦理限制的平台,为药物筛选提供了新的平台,也是对现有2D培养方法和动物模型系统的高信息量的互补 。此外,类器官为获取更接近自然人体发育细胞用于细胞治疗成为可能。通过类器官繁殖的干细胞群取代受损或者患病的组织,类器官提供自体和同种异体细胞疗法的可行性,未来这一技术在再生医学领域也拥有巨大的潜力 。使用这项技术,采用CRISPR/Cas9能够纠正体外遗传异常并能够将健康的转基因细胞再次回输入患者体内,并在后期整合入组织内。在医学应用中,患者衍生的类器官也被证明为有价值的诊断工具。在进行治疗之前,采用从患者样本来源的类器官筛查患者体外药物反应,旨在为癌症和囊胞性纤维症患者的护理提供指导并预测治疗结果。随着类器官培养系统以及其实验开发技术的不断发展,类器官应用到了各大研究领域。
类器官可以模拟人体的内外环境和人体器官,帮助研究人员观测用药会对人体器官功能产生什么样的影响。在提倡精 X 准医学和个体化治疗的时代,类器官研究比传统的二维细胞培养更具有针对性,并且可以区别不同癌症对于相同药物的反应。不仅如此,研究者还希望通过诱导多功能干细胞强大的再生潜能,体外生成新的器官或组织,然后移植入体内以替代损坏的组织器官。

类器官培养系统--- HUMIMIC的应用案例
肠类器官:HansClever 课题组证实单一的Lgr5 +干细胞能够在体外持续增殖并自组装形成隐窝-绒毛样的小肠上皮结构。进一步的研究结果显示,单个成人Lgr5 + 干细胞也能在体外成功扩增成结肠类器官,将这种功能性的结肠上皮移植到硫酸葡聚糖诱导的急性结肠炎小鼠模型中可以修复其受损的结肠上皮。这提示利用单一成人结肠干细胞体外扩增进行结肠干细胞治疗是可行的。有学者还应用人诱导型干细胞( induced pluripotent stem cells,iPSCs) 直接定向分化为小肠组织的方法明确了Wnt3a 蛋白和成纤维细胞生长因子4 是后肠特定分化所必需的物质,而且,这种iPSCs体外构建的人体肠道组织中存在的小肠干细胞,也具有小肠特有的吸收和分泌功能。这有助于未来人肠道疾病药物的设计研究,可大大提高了药物利用率。目前,已有学者构建了小鼠小肠3D 类器官来进行P-糖蛋白抑制剂的筛选,为P-糖蛋白介导的药物转运研究提供了强有力的工具。
肝类器官:2013 年,Takebe 等将人干细胞来源的肝细胞、人间充质干细胞和人内皮细胞混合后在基质胶中培养,发现3 种细胞自组装成3D 化肝芽,将该肝芽移植到丙氧鸟苷诱导肝脏衰亡的TKNOG 小鼠体内后发现这种肝芽可以连接小鼠肠系膜血管,小鼠也出现了人类特有的药物代谢过程。这为肝脏器官发生的研究提供了有益尝试。大型哺乳动物的类器官再造工程也许能加速人类器官的移植治疗和疾病致病机制研究的进展。2015 年,Nantasanti 等利用狗的肝脏干细胞构建了可分化为功能性肝细胞的肝类器官模型,能用于铜潴留症的治疗。猫被认为是非常适用于研究人类代谢性疾病的模型,所以利用猫的胆道组织构建肝类器官,可能是原发性肝胆疾病研究及药物筛选的有益工具,但至今也未见利用猫建立保持基因稳定的肝脏干/祖细胞培养体系的报道。
胰腺类器官:有学者发现,当控制骨形态发生蛋白碱性成纤维细胞生长因子、激活素A 和Wnt3a 的表达水平或使用一些小分子化合物进行干预时,可以控制内胚层细胞向特定的方向分化,* 终形成胰腺。目前,构建胰岛类器官的主要方法包括利用各种干祖细胞产生胰岛样细胞群和利用各种来源的胰腺细胞悬液或胰腺组织块自组装成拟胰岛体。2011 年,Saito 等将人iPSCs 和胚胎小鼠胰岛细胞体外共培养,* 后形成能够产生胰岛素的不成熟细胞群,该细胞群由胰岛α 细胞包绕中央的β 细胞构成,这种结构和成年鼠胰岛相似,将其移植到链脲菌素诱导的高血糖小鼠模型中后发现小鼠血糖水平得到改善。而进一步的体内实验研究还需要关注如何规避免疫反应、促进再血管化、促进类器官分化发育等问题,在这方面,Sabek 等提出制备纳米腺体来促进胰岛发挥作用,这种纳米腺体是运用3D 打印技术制作可吸收聚合物胶囊包裹胰岛样细胞团形成的,这可能是未来胰岛类器官应用的一种思路。
脑类器官:近来,谱系重编程技术为获取特异性种子细胞提供了新的途径。Lancaster 等通过加入不同生长因子的方法将人类胚胎干细胞( embryonic stem cell,ESC) 和iPSC 在神经培养基3D 培养出了与9 ~ 10周胚胎大脑类似的“类大脑”,此类迷你大脑具备人类大脑发育初期的一些主要区域,也出现了背侧皮层、腹侧前脑等可辨认的特征,但由于缺乏一些特定的特征,如小脑、海马状突起等,这些区域无法应用于干细胞模型。之后,该研究者利用小颅畸形患者的皮肤成纤维细胞诱导形成了患者特异性iPSC 细胞系,并应用后者构建了小颅畸形脑类器官模型,通过对照实验发现,正常ESC和该iPSCs 在类器官形成上并没有明显差异,但是后者形成的类器官中有大量未成熟的神经元分化,这为大脑发育紊乱类疾病的研究提供了一定的思路。2015年Kirwan 等应用人iPSC 体外构建了人大脑皮层神经网络,能够模拟人体内皮层网络的发育和功能,这表明可以在体外通过构建大脑类器官来进行人类前脑神经网络生理学机制的研究。
前列腺类器官:2014 年,研究人员在实验室利用来自转移性前列腺癌患者的活检标本和去势抵抗性前列腺癌( castration-resistant prostate cancer,CRPC) 患者的循环肿瘤细胞成功培育出7 个前列腺癌类器官,这些前列腺癌类器官以及从中获得的肿瘤移植物的组织结构及基因突变谱与患者转移灶样本高度相似。Nicholson 等[21]也应用类器官培养技术成功在体外构建患者来源的异种移植物模型,相比于人源性肿瘤组织异种移植及基因工程鼠模型,这种新型的患者来源的类器官能更好地代表CRPC 等别前列腺癌,还能代表前列腺癌的庞大临床疾病谱,而这种疾病谱是目前仅有的前列腺癌细胞系无法代表的,因而在前列腺癌药物筛选和个体化治疗中展现出巨大的应用前景。

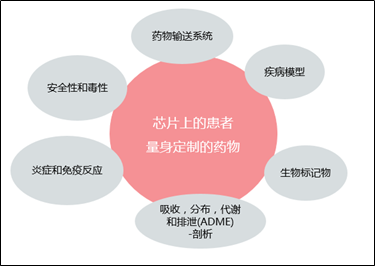
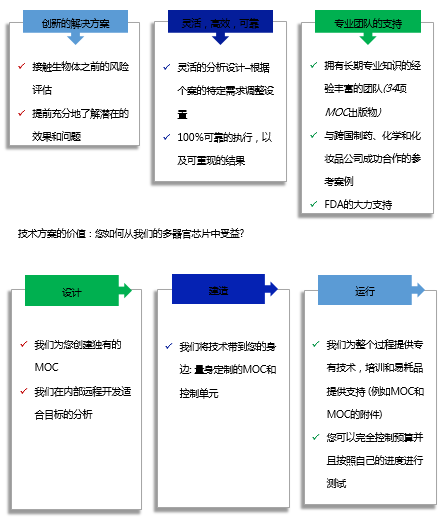
类器官培养系统--- HUMIMIC的技术方案:在没有病人的情况下测试病人
为获取更高相关与的测试结果,我们开发了人体器官模型的自动芯片测试:
配备具有指示相关性的器官模型的芯片,以能够在接触生物体之前检测其安全性和性
*终为芯片配备患者自身相关病变器官的亚基,以评估整个个性化治疗的效果
技术方案的配套系统:专业化的硬件、专业化的软件、特定细胞、芯片系统、技术服务
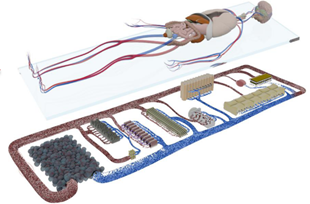
一、技术方案的配套系统:专业化的硬件
专门设计用于在芯片上进行多重类器官培养的系统。该系统能够模拟人体内生理环境,包括温度,湿度,气流,压力,液体流动等等,芯片底部有不通的微流道设计,针对不同的器官,可以单独设置提供相应的培养条件,提供培养和分化环境。能均一的获得用于研究或药物筛选的类器官,具有较好的重复性。自动化细胞培养、分化一体设备可以提高类器官定向分化成功率。包括:自动培养模块;自动换液模块(可以执行至少多种不同的培养基/溶液的换液操作)。该系统能同时培养4种不同的类器官,通过微流控联在一起,进行多器官串联培养研究。

二、技术方案的配套系统:专业化的软件
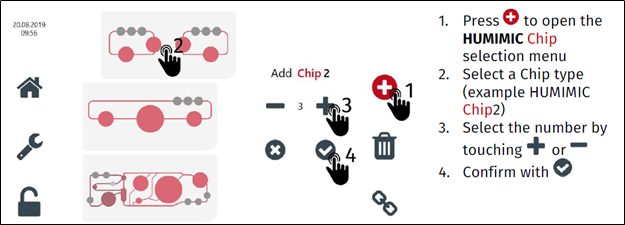
TissUse Control Unit 自带液晶触摸控制屏,无需外接电脑,软件操控非常友好,可以自主设置每个器官芯片的培养条件,包括温度,压力,真空百分比,时间等参数,来达到器官培养的条件。此外,TissUse Control Unit不需要除了器官芯片之外的耗材,也不需要频繁繁琐的维护,半年进行一个维护校准即可,使用维护成本较低。
三、技术方案的配套系统:特定细胞
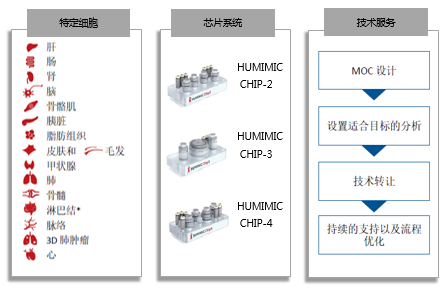
四、技术方案的配套系统:芯片系统

五、技术方案的配套系统:技术服务
参考文献
1. Maschmeyer, I., et al., A four-organ-chip for interconnected long-term co-culture of human intestine, liver, skin and kidney equivalents. Lab Chip, 2015. 15(12): p. 2688-99.
2. Ramme, A.P., et al., Autologous induced pluripotent stem cell-derived four-organ-chip. Future Sci OA, 2019. 5(8): p. FSO413.
3. Wagner, I., et al., A dynamic multi-organ-chip for long-term cultivation and substance testing proven by 3D human liver and skin tissue co-culture. Lab Chip, 2013. 13(18): p. 3538-47.
4. Maschmeyer, I., et al., Chip-based human liver-intestine and liver-skin co-cultures--A first step toward systemic repeated dose substance testing in vitro. Eur J Pharm Biopharm, 2015. 95(Pt A): p. 77-87.
5. Materne, E.-M., et al., A multi-organ chip co-culture of neurospheres and liver equivalentsfor long-term substance testing. Journal of Biotechnology, 2015. 205: p. 36–46
6. Schimek, K., et al., Human multi-organ chip co-culture of bronchial lung culture and liver spheroids for substance exposure studies. Scientific Reports, 2020. 10(1): p. 7865.
7. Bauer, S., et al., Functional coupling of human pancreatic islets and liver spheroids on-a-chip: Towards a novel human ex vivo type 2 diabetes model. Sci Rep, 2017. 7(1): p. 14620.
8. Sieber, S., et al., Bone marrow-on-a-chip: Long-term culture of human haematopoietic stem cells in a three-dimensional microfluidic environment. J Tissue Eng Regen Med, 2018. 12(2): p. 479-489.
9. Hasenberg, T., et al., Emulating human microcapillaries in a multi-organ-chip platform. J Biotechnol, 2015. 216: p. 1-10.
10. Schimek, K., et al., Bioengineering of a Full-Thickness Skin Equivalent in a 96-Well Insert Format for Substance Permeation Studies and Organ-On-A-Chip Applications. Bioengineering (Basel), 2018. 5(2).
11. Hubner, J., et al., Simultaneous evaluation of anti-EGFR-induced tumour and adverse skin effects in a microfluidic human 3D co-culture model. Sci Rep, 2018. 8(1): p. 15010.
12. Atac, B., et al., Skin and hair on-a-chip: in vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab Chip, 2013. 13(18): p. 3555-61.
13. Schimek, K., et al., Integrating biological vasculature into a multi-organchip microsystem. Lab Chip, 2013. 13(18): p. 3588-98.
14. Ni, L., et al., Repeated dose multi-drug testing using a chip-based co-culture of human liver and kidney proximal tubules equivalents. Scientific Reports, 2020. 10, 8879
15. Baert, Y., et al., A Multi-Organ-Chip Co-Culture of Liver and Testis Equivalents: A First Step Toward a Systemic Male Reprotoxicity Model. Human Reprod., 2020, 11;deaa057. doi: 10.1093/humrep/deaa057
16 Kühnlenz, J., et al.. Establishment of a multi-organ-chip based identification platform for endocrine disruptors. Abstracts of the 55th Congress of the European Societies of Toxicology (EUROTOX 2019) TOXICOLOGY – SCIENCE PROVIDING SOLUTIONS Toxicol Lett. 2019, 314, 293. doi:10.1016/j.toxlet.2019.09.002
17 Schoon, J. et al., Metal-Specific Biomaterial Accumulation in Human Peri-Implant Bone and Bone Marrow. Adv. Sci. 2020, doi.org/10.1002/advs.202000412









