企业档案
会员类型:初级版会员

已获得易推广信誉 等级评定
(0 -40)基础信誉积累,可浏览访问
(41-90)良好信誉积累,可接洽商谈
(91+ )优质信誉积累,可持续信赖
易推广初级版会员:3年
最后认证时间:
注册号: 【已认证】
法人代表: 【已认证】
企业类型:经销商 【已认证】
注册资金:人民币1000万 【已认证】
产品数:83
参观次数:43548
技术文章
使用功能性OCT对肿瘤微血管进行临床成像研究
点击次数:33 发布时间:2022/5/7 11:30:46
放射疗法广泛用于癌症治疗,目技术朝着以更少的分割提供更高剂量发展,但这可能会引起细胞和微血管损伤。微血管系统可能是放疗早期应答的功能生物标志物,然而很难直接且非侵入地测量微血管应答情况,其时间进程、剂量依赖性和在肿瘤控制中的总体重要性也尚不清楚。针对这种情况, canada研究人员Valentin Demidov等使用功能性OCT,结合人肿瘤异种移植物临床模型,对单次10、20和30 Gy放射剂量下肿瘤的微血管应答情况进行了体内纵向定量成像研究,对放疗后血管重塑进行了详细评估。定量评估了微血管对放疗的即时(几分钟至几十分钟)和早期(几天至几周)应答、肿瘤体积及荧光强度,与文献报道过的理论模型进行了比较讨论,发现这些放疗应答虽稳定但很复杂,且随时间呈剂量依赖性。该研究成果以“Preclinical longitudinal imaging of tumor microvascular radiobiologicalresponse with functional optical coherence tomography”为题发表于SCIENTIfIC REPORTS。
背景
放射疗法(radiation therapy, RT)广泛应用于癌症治疗中。靶向肿瘤癌细胞的常见临床剂量为每分割2 Gy,每天给药,持续5-6周,总累积剂量为50-70 Gy,目认为这种分割方案是临床效果zuihao的。放射治疗传递和放射生物学肿瘤效应监测方面取得的成果促进了立体定向放射疗法(stereotactic body radiation therapy, SBRT)的发展,该疗法能以更少分割及每分割更高剂量来提高对肿瘤内的局部控制,并降低对周围正常组织的损伤。
有临床研究证明,较高剂量的辐射能通过肿瘤微血管损介导的“非经典”放射生物学机制,诱导更多肿瘤细胞死亡。具体来说,Fuks和Kolesnick认为这种抗肿瘤能力的提升归因于血管损伤,且需要的小阈值剂量为约8-10 Gy。同样,接受高剂量放疗的肿瘤反应高于现有的生物学模型预测的水平。这可能与肿瘤中活跃的血管新生有关,血管新生过程中血管内皮细胞增殖速率显著增加,可能使肿瘤脉管系统对电离辐射更加敏感。据报道,肿瘤内皮细胞的死亡会启动炎症联反应,产生缺氧、酸性和营养缺乏的微环境,会使辐射的毒性增强。
尽管进行了大量研究,但大剂量放疗后的肿瘤应答的潜在生物学机制仍不明确。对于放疗后不同阶段的血管变化动力学、肿瘤血管的组织性、血管生成和新血管形成情况也知之甚少。主要还是因为无法从毛细管水平对这些动力学应答进行原位研究。结合针对40多项临床研究的综述发现,放疗微血管应答方面缺乏实验共识,不同实验方案(动物模型、细胞系、x射线能量、剂量水平)、不同成像和定量技术(离体免疫组化、多普勒超声和体内计算机断层扫描等)得到的数据相互矛盾。虽然针对放疗血管应答效果提出了几个理论上的机制模型,但几乎没有直接的体内实验数据能来支持和验证这些模型。了解肿瘤微脉管系统对放疗的应答机制,不但有可能实现个性化放疗,同时还有助于帮助改善SBRT等更大程度涉及肿瘤微脉管系统的高剂量的放疗方法的应用。
已知肿瘤毛细血管对辐射特别敏感,但大多数成像方式(超声、磁共振成像、共聚焦荧光显微镜等)的分辨能力达不到要求,或需造影剂才能实现可视化及纵向监测其反应。本研究利用功能性光学相干断层扫描(OCT)来研究肿瘤微脉管系统对放射治疗的应答。OCT是一种无标记wuchuang3D光学成像方式,用于活体观察皮下组织细节,并能在微循环水平观察血流细节。OCT还具有很强的扩展性,如散斑方差光学相干断层扫描(svOCT),能够对活体微血管进行三维深度分辨成像。svOCT图像的内源性对比度源于血管内的血液和周围“固体”组织之间不同的光散射特性。在放疗后跟踪检测肿瘤脉管系统时,svOCT不需要造影剂,且扫描时间短(几至几分钟,取决于肿瘤大小)、处理速度快、成像深度好(1-3mm,取决于组织和肿瘤类型)、不受血流或血管方向影响。另外OCT扫描仪现在相对便宜,又便携。
本研究建立在十年背景工作的基础上。初Mariampillai等人开发了用于微血管监测的svOCT方法。Leung等人设计了加热式动物固定器。Maeda等人优化了背部皮肤窗室(dorsal skin window chamber, DSWC)模型,并对单次30 Gy剂量放射疗法的短期反应(2周)进行了初步研究。Conroy等人开发了利用生物计量学进行脉管系统量化的后处理技术。本研究在过去十年经验的基础上,从根本上改进和完善了成像和分析平台的方方面面,使得它能够识别血管放射生物学反应。
选择NOD-Rag1nullIL2rγnull(NRG)小鼠品系进行本研究,它具有抗辐射和免疫缺陷的特性。使用Bx-PC3人胰腺癌细胞研究其对辐射的反应。选择管体积密度(vascular volume density, VVD)作为微血管度量标准,因为它计算简单(血管像素的数量除以选定体积中的总像素)、稳定性好、受操作员影响小且结果复制方便。还进行了两项与脉管系统无关的测量来跟踪放疗:每次svOCT成像后,用卡尺测量肿瘤体积并使用荧光显微镜测量肿瘤细胞的荧光强度。切除放疗后的肿瘤,进行组织学染色和组织病理学评估,以支持和验证体内纵向观察结果。
图1 (a)携带BX-PC3肿瘤的NRG小鼠。背部在DSWC安装被剃光。(b)DSWC安装过程中生长的肿瘤。(c)安装了DSWC的小鼠。(d)DSWC安装后9周并放射治疗后7.5周(单剂量20 Gy)的小鼠。(e)将NRG小鼠置于小动物辐照器中。225kVp x光从底部入射。(f)DSWC内的肿瘤图像。(g)在10 Gy单剂量放疗后,肿瘤颜色发生变化。
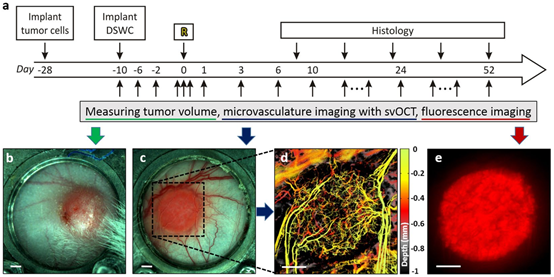
图2 实验时间进程。在Day-28,将肿瘤细胞注射到背部皮肤中。当肿瘤体积达到3-5 mm后植入DSWC。植入后约10天对肿瘤进行照射(Day 0,标记为“R”)。放射后,立即检测90 min内的肿瘤脉管系统。在放射后的5至8周内,用卡尺测量(肿瘤体积)、svOCT成像(脉管系统)和表荧光显微镜成像(癌细胞荧光)重复监测肿瘤变化。选择几只动物在放疗后进行肿瘤切除并进行组织学染色,以支持和验证体内观察结果。(b)肿瘤背面图。(c)肿瘤正面图。(d)svOCT微血管图(c中黑色虚线框)。(e)肿瘤细胞Ds-Red荧光图像。

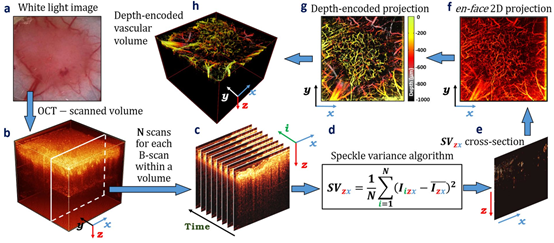
图4 通过svOCT实时成像的肿瘤微脉管系统。(a)DSWC中的肿瘤组织。(b)6 × 6mm2视野的OCT体积式图像。(c)同一位置的8次连续B-scan,用于svOCT分析所需的的frame间比较。(d)进行frame间像素纹理比较的算法。(e)使用svOCT算法获得的SVzx血管横截面。(f)血管en-face二维投影。(g)深度编码的血管en-face二维投影。(h)b图组织中深度编码的血管。
结果
01-放射肿瘤的脉管系统生长情况
如图5所示,皮下注射肿瘤细胞后约2周内,肿瘤脉管系统侵袭性地活跃发展。注射后第3天,邻近正常组织中出现微血管生长(图5a),一周后形成爪状(图5b),约第10天形成连接(图5c),随后更多的新血管在肿瘤内迅速发芽,并在几天内da的脉管化(图5d)。肿瘤中血管床的结构与正常组织中的有明显不同,正常组织中血管床结构分更明确(图5e),且血管分布更有序、更均匀,以使营养物和氧气能充分灌注到所有细胞中。相反肿瘤血管不成熟、弯弯曲曲、直径不规则、还经常有严重弯曲,形成一个没有层次的混乱迷宫,无法清楚识别其中的小动脉、毛细血管和小静脉。
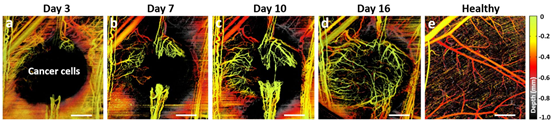
图5 皮下注射癌细胞后16天内BX-PC3胰腺肿瘤的脉管系统发育情况。(a)注射后3天;(b)7天;(c)10天;(d)16天。(e)用于比较的健康组织脉管系统。
02-放射治疗后的肿瘤生长动力学变化
已知对人肿瘤异体移植模型进行单次高剂量照射会造成血管的快速改变。图6中深度编码的svOCT证实了10 Gy放射后微血管的这种即刻反应。放疗半小时后,血管体积密度显著降低了26%(图6a, b)。小血管(直径10-30 μm)反应zuida,中小血管(直径30-70 μm)受影响较小。
但多数血管密度改变似乎是非yongjiu性的。在放疗后45 min和60 min都检测到微循环恢复(图6c,d),并且在90 min恢复到初始血管的90%(图6e)。这可能是放射后暂时性微血管血栓形成或毛细血管与旁路合流造成的,换句话说,那些在放疗后较晚时间点重新出现的血管并没有因为放疗而yongjiu受损。约10%的血管yongjiu消失,可能是由于放射诱导的内皮细胞死亡,以及血浆蛋白外渗引起的间质液压力升高,导致脆弱的肿瘤血管塌陷。
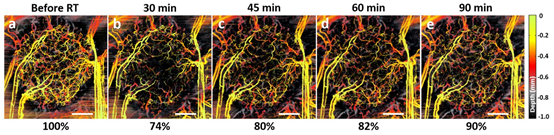
图6 单次10 Gy剂量放疗后,1.5h内的肿瘤微血管应答。(a)放射;(b)放射后30 min;(c)45 min;(d)60 min;(e)90 min。图下方数字为放射后血管体积密度与放射密度的比率。
图7为6周内(放疗1周至放疗后5周),单次20 Gy剂量放疗对肿瘤微血管的影响。肿瘤wanquan血管形成后进行放射(Day-0),放射后1.5 h观察到初始反应(Day+0),血管密度为放射的83%。放疗后t = 2、6、8天与肿瘤边缘的血管相比,肿瘤核心的血管更容易受到影响。这支持了以的推测,即肿瘤周围的部分血管网约等于正常血管,是由组织正常血管出芽继续向肿瘤内发生形成的,与肿瘤核心区血管形成产生的新肿瘤血管相比,这些血管可能更耐辐射。
约10天以上的数据进一步证明,肿瘤会通过存活血管的生长来重新构建其脉管系统,这与早期的研究和假设一致,即局部照射后肿瘤的再生长依赖于存活下来的内皮细胞生成的血管。此外在10天以上的血管重建过程中,肿瘤区域似乎也变得越来越小。

图7 肿瘤脉管系统对单次20 Gy剂量放射的应答。Day-0图像在放疗1 h拍摄,Day+0为放疗后1.5 h。对肿瘤脉管系统的zuida抑制约在第8天。
除以上成果外,本研究中的svOCT平台的真正价值在于其巨大的成像吞吐量能力和可量化度量的提取。因此,对整个动物研究(n=60)进行了定量总结,对应三个放射剂量水平(再加上未放射的对照),三个测量变量的应答情况:从svOCT图像中提取的肿瘤VVD(图8a)、通过卡尺测量获得的肿瘤体积(图8b)、通过显微镜获得的荧光强度(图8c)。
纵向监测了约10周,从中总结出几个较为明显的变化趋势:
- 放射会抑制血管密度(可抑制达放射后2-4周);
- 抑制程度随剂量水平而增加(10 Gy后2周下降约10%,30 Gy后4周下降约70%);这种减少是暂时的(因此单剂量不足以yongjiu控制肿瘤),终血管密度恢复到放射的水平;
- 血管密度恢复到放射水平的时间随剂量增加而增加(10 Gy约3.5周,30 Gy时8周以上);
- 放射后1.5 h内,高放射剂量组中肿瘤微血管的应答更明显(30 Gy后23%的微血管显示暂时关闭,而10 Gy后为10%)。大多数为直径小于30 μm的微血管;
- 对比接受放射的三组及未放射的对照组,计算组间是否确实有差异。对于t >1.5周,确定有差异,P值在0.0001-0.01范围内。对于从照射刚刚结束到1-1.5周,情况不明确,P值在0.03-0.15范围内(10 Gy到0 Gy组间zuidaP值出现在t < 1周时)。因此得出结论,微血管应答差异随剂量的增加而增加,且需要约1-1.5周才能明确显示出来。
已知肿瘤DsRed荧光强度可代表癌细胞活力水平,并能用于间接测量肿瘤中低氧细胞比例。图8c为三种剂量下该度量的应答曲线,同样,曲线总体形状与VVD和肿瘤体积曲线类似,显著不同的是在放射后很早期荧光强度急剧下降。具体而言,放疗后一天内,肿瘤细胞荧光强度显著下降(10 Gy下降14%,20 Gy下降30%,30 Gy下降48%)。随后1-2周略微增加,随后是另一次下降(10 Gyzuidi点在3周达85%;20 Gy在4周达60%;30 Gy在5周达30%)。随后的恢复时间也呈剂量依赖性:4周(10 Gy)、6.5周(20 Gy)和7.5周以上(30 Gy)。
图8d为单次20 Gy剂量时,三个度量的应答变化情况,以更好地理解和解释其间的关联。放射后不久,肿瘤细胞荧光强度明显下降,伴随肿瘤毛细血管和小血管塌陷,随后脉管系统在头两天内部分恢复。肿瘤细胞杀伤(直接细胞损伤和脉管诱导的细胞死亡结合)导致肿瘤生长停滞,肿瘤在初的10天内尺寸逐渐减小。对于脉管诱导的细胞死亡机制,在20世纪80年代有人指出,一个内皮细胞可对应一块含多达2000个肿瘤细胞的肿瘤部分,因此一个内皮元件的崩溃可能导致沿着失效血管的肿瘤细胞死亡雪崩。如结果所示,与肿瘤体积相比,VVD响应在时间和幅度上先。随着肿瘤收缩VVD呈现平稳状态,更多的癌细胞获得氧气和营养,这可能是肿瘤暂时fufa(t~2周)的原因。尽管存在短暂的体积增加趋势,但血管数量继续减少,可能导致局部缺氧(肿瘤荧光曲线),并导致放疗后第4周肿瘤显著收缩至原始大小的45%。放疗后约2周,通过存活血管的生长开始肿瘤再血管化。随着血管开始再生长并从周围组织萌出进入肿瘤(图6,第13-35天),肿瘤荧光强度也开始增加(延迟几天)。几天后,肿瘤停止收缩,随后在7.5周wanquan再生。
图8e为Kozin等人于2012年提出的放射生物学理论模型,基于迄为止不同的(并且经常是相互矛盾的)放射的组织研究报告。尽管数据不是zuijia的,但作者确实提出了单次高剂量放射后微血管动力学的所谓机制,包括肿瘤体积收缩和随后再生长。理论上预测的肿瘤体积曲线的总体形状与我们研究的实验数据非常一致。
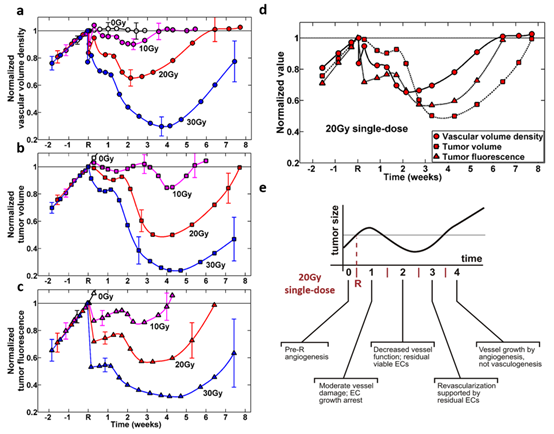
图8 单次10、20和30 Gy剂量局部放射后,通过血管体积密度(VVD)、肿瘤体积和荧光强度的变化反映出的肿瘤发展动力学。(a)肿瘤微血管应答。(b)肿瘤体积应答。(c)肿瘤荧光应答。未受照射的肿瘤(0 Gy数据)因生长过大无法显示所有数据。(d)20 Gy单剂量辐照的VVD、体积和荧光应答的总结图表。(e)文献提出的肿瘤生长和20 Gy单剂量照射后微血管相应变化的模型。
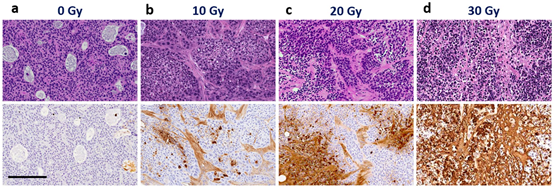
图9 H&E(上排)和TUNEL(下排)染色图片。(a) 0 Gy放射;(b)10Gy;(c)20Gy;(d)30Gy。放疗后2周切除肿瘤。整个肿瘤切片中TUNEL阳性率分别为0.3%、15.8%、47.6%和97.7%。
结论
参考文献:
Demidov, Valentin , et al. "Preclinical longitudinal imaging of tumor microvascular radiobiological response with functional optical coherence tomography." Scientific Reports 8.1(2018):38.
原创作者:北京心联光电科技有限公司







