企业档案
会员类型:初级版会员

已获得易推广信誉 等级评定
8成长值
(0 -40)基础信誉积累,可浏览访问
(41-90)良好信誉积累,可接洽商谈
(91+ )优质信誉积累,可持续信赖
易推广初级版会员:3年
最后认证时间:
注册号: 【已认证】
法人代表: 【已认证】
企业类型:经销商 【已认证】
注册资金:人民币1000万 【已认证】
产品数:83
参观次数:43539
技术文章
单扫描血管成像技术-光谱对比OCT血管造影术(SC-OCTA)
点击次数:89 发布时间:2022/5/24 15:25:20
通常的OCT血管造影术依靠运动来产生对比,并且每个扫描点至少需要采集两次数据,不仅成像时间较长且受运动状态影响较大。美国学者James A. Winkelmann等提出了一种光谱对比OCT血管造影术的方法,即使用可见光,利用血管中内源物质不同的光谱特性,如血红蛋白,实现单次扫描造影。研究证实该方法不但具有分子敏感性,还能够成功区分出淋巴管、血液和组织。研究成果在2019年以“Spectral contrast optical coherence tomography angiography enablessingle-scan vessel imaging”为题发表于Light: Science & Applications。
除基于运动的OCT血管造影术之外,通过分辨不同光谱的吸收特征的SD-OCT(spectral domain OCT)在成像中也取得大进展。光谱可见波段OCT成像使生物组织带上了真彩色。随着可见光谱OCT的发展,通过内源性造影剂定量血红蛋白浓度和氧合,通过外源性纳米颗粒造影剂获得分子信息将成为可能。
本研究提出了一种新颖简便的血管造影成像的方法,称为SC-OCTA(spectral contrast OCT angiography)。SC-OCTA利用血红蛋白的独特光谱特征,无需重复扫描即可进行3D血管造影,不仅能避免之OCTA普遍存在的基于运动的伪影,并实现了迄为止快的SD-OCT血管造影采集速度。此外,这种基于光谱的血管分割方法对血流运动没有要求,因此能够对止血组织中的脉管系统成像,如心血管疾病中受损脉管系统出血。
通常生物成像倾向于使用约700-900 nm的近红外(near-infrared, NIR)区域,因为相较于大于1000 nm的长波长,短波长能提供更高的OCT轴向分辨率,并且该区域落在“光学窗口”内。在“光学窗口”中,水和血红蛋白的吸收小,使得光波能够高度渗透入组织中。这不但使得NIR OCT系统能够深入组织,同时降低了对血液和组织散射光谱特征的敏感性。血液吸收系数在400-600 nm内会高两个数量,组织散射系数也会约为正常的两倍,这使可见光OCT系统对血液氧化敏感,能获得更高的图像对比度。
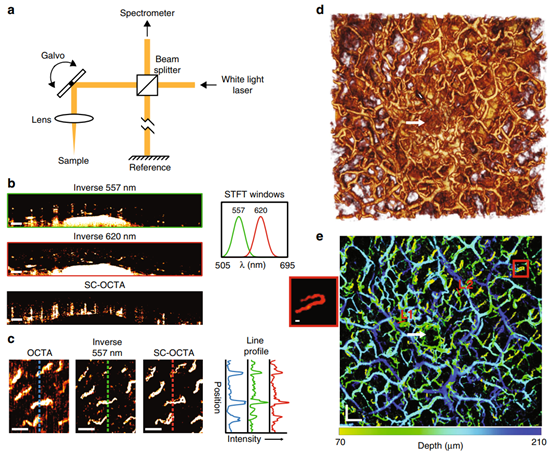
SD-OCT通过对获取的干涉记录进行傅立叶变换来获取不同深度的样本信息(图1a)。通过短时傅里叶变换(STFT)对光谱进行二次采样,获得光谱相关的OCT A-line。因此,通过观察550-600 nm光谱相关OCT图像强度的对比度,可以在空间上观察到血液和组织的相反光谱斜率。研究人员在557和620 nm处发现Kaiser窗口,其半峰全宽(FWHM)约为38 nm,在血液和周围组织之间呈现高光谱对比度。
为证实毛细血管成像能力,比较了反向557 nm和SC-OCTA正面投影与传统的OCTA相位和振幅对比结果(图1c)。发现几种成像图中都可以看到唇粘膜中相同的八个毛细血管环,但传统OCT血管造影术需要对样本进行至少两次扫描。获取传统OCTA数据需要18.2 s,SC-OCTA数据需要4.5 s。傅里叶环相关分析得到传统OCTA的有效分辨率为20.19 μm,反向557 nm的有效分辨率为12.2 μm,SC-OCTA的有效分辨率为8.92 μm。这一分析表明相较于OCTA,反向557 nm和SC-OCTA对体内运动不敏感。唇粘膜的详细大视野证明了SC-OCTA在每个点扫描位置仅用一条A-line就能分辨出小动脉和毛细血管(图1d,e)。此外反向557 nm图像无法区分低散射结构和血红蛋白吸收,图1d中可见白色箭头所示的唾液腺导管,但在SC-OCTA图像中不可见(图1e)。
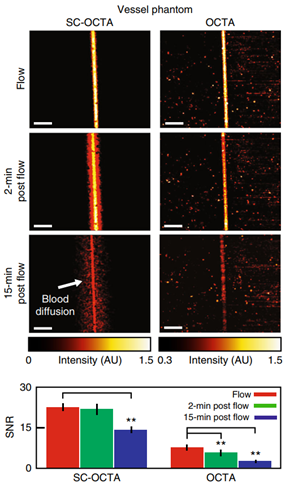
因为SC-OCTA不依靠运动来进行对比,所以它可以对不流动的血液和高度运动的样本进行成像。研究人员制作了一个直径约为55 μm的牛血管模型,并记录了不同流量(图2)和振动下SC-OCTA和OCTA信号的信噪比。结果表明,与OCTA相比,SC-OCTA信号受流动的影响不显著,因此可以对高度运动的样本成像。
为证明SC-OCTA在止血情况下的效用,对新处死的小鼠大肠的浆膜表面进行了成像(图3)。这是已知的shouci使用OCT对具有内源性造影剂的非运动血液的组织进行血管造影。结果表明,OCTA在止血情况下难以分辨出任何血管,而SC-OCTA可以快速检测到几个血管(图3a)。
为证明SC-OCTA的分子敏感性,对新处死的小鼠网膜淋巴管和血管(图4a-d)以及心脏表面进行成像,并将同一心脏表面的成像图与组织学成像进行比较(图4e-g)。发现SC-OCTA能够将血管从低散射的淋巴管和脂肪细胞中区分出来。结合SC-OCAT和反向557 nm图像得到的depth-integrated SC-OCTA,其B-scan能够在三维空间显示出血管信息(图4),能够在毛细血管水平将唇粘膜脉管系统从唾液腺导管和组织中区分出来。此外depth-integrated SC-OCTA还展现出冠状动脉分支成像的能力,并能将其与邻近的淋巴管区分开来(图4e)。高分辨率和对比度还允许对淋巴管进行成像,能够轻易辨别出其中瓣膜的三尖瓣结构(图4d)。
研究背景
除基于运动的OCT血管造影术之外,通过分辨不同光谱的吸收特征的SD-OCT(spectral domain OCT)在成像中也取得大进展。光谱可见波段OCT成像使生物组织带上了真彩色。随着可见光谱OCT的发展,通过内源性造影剂定量血红蛋白浓度和氧合,通过外源性纳米颗粒造影剂获得分子信息将成为可能。
本研究提出了一种新颖简便的血管造影成像的方法,称为SC-OCTA(spectral contrast OCT angiography)。SC-OCTA利用血红蛋白的独特光谱特征,无需重复扫描即可进行3D血管造影,不仅能避免之OCTA普遍存在的基于运动的伪影,并实现了迄为止快的SD-OCT血管造影采集速度。此外,这种基于光谱的血管分割方法对血流运动没有要求,因此能够对止血组织中的脉管系统成像,如心血管疾病中受损脉管系统出血。
通常生物成像倾向于使用约700-900 nm的近红外(near-infrared, NIR)区域,因为相较于大于1000 nm的长波长,短波长能提供更高的OCT轴向分辨率,并且该区域落在“光学窗口”内。在“光学窗口”中,水和血红蛋白的吸收小,使得光波能够高度渗透入组织中。这不但使得NIR OCT系统能够深入组织,同时降低了对血液和组织散射光谱特征的敏感性。血液吸收系数在400-600 nm内会高两个数量,组织散射系数也会约为正常的两倍,这使可见光OCT系统对血液氧化敏感,能获得更高的图像对比度。
SD-OCT通过对获取的干涉记录进行傅立叶变换来获取不同深度的样本信息(图1a)。通过短时傅里叶变换(STFT)对光谱进行二次采样,获得光谱相关的OCT A-line。因此,通过观察550-600 nm光谱相关OCT图像强度的对比度,可以在空间上观察到血液和组织的相反光谱斜率。研究人员在557和620 nm处发现Kaiser窗口,其半峰全宽(FWHM)约为38 nm,在血液和周围组织之间呈现高光谱对比度。
结果与讨论
为证实毛细血管成像能力,比较了反向557 nm和SC-OCTA正面投影与传统的OCTA相位和振幅对比结果(图1c)。发现几种成像图中都可以看到唇粘膜中相同的八个毛细血管环,但传统OCT血管造影术需要对样本进行至少两次扫描。获取传统OCTA数据需要18.2 s,SC-OCTA数据需要4.5 s。傅里叶环相关分析得到传统OCTA的有效分辨率为20.19 μm,反向557 nm的有效分辨率为12.2 μm,SC-OCTA的有效分辨率为8.92 μm。这一分析表明相较于OCTA,反向557 nm和SC-OCTA对体内运动不敏感。唇粘膜的详细大视野证明了SC-OCTA在每个点扫描位置仅用一条A-line就能分辨出小动脉和毛细血管(图1d,e)。此外反向557 nm图像无法区分低散射结构和血红蛋白吸收,图1d中可见白色箭头所示的唾液腺导管,但在SC-OCTA图像中不可见(图1e)。

图1 人唇粘膜的活体成像。a.可见光OCT系统的简化示意图,可获得样本的3D光谱信息。b-e.健康志愿者唇粘膜(下唇)的活体成像。b.反向557 μm和反向620 μm的B-scan及其相应的STFT窗口,以及显示每个血管对比阴影的SC-OCTA B-scan。c.表面毛细血管环的血管造影正面投影与传统运动对比OCTA(64–111 μm)的比较、反向557 μm(55.6–140 μm)和SC-OCTA(83–209 μm)的表面毛细血管环的正面投影,及其相应的投影强度的比较。d.反向557 nm的3D渲染。e.与图d同一视场的深度编码血管图,包含来自SC-OCTA的饱和度和数值,以及来自反向557 nm的血管深度色调。红色方框为毛细管回路放大图。d和e中白色箭头为SC-OCTA正确未识别的唾液腺导管。
因为SC-OCTA不依靠运动来进行对比,所以它可以对不流动的血液和高度运动的样本进行成像。研究人员制作了一个直径约为55 μm的牛血管模型,并记录了不同流量(图2)和振动下SC-OCTA和OCTA信号的信噪比。结果表明,与OCTA相比,SC-OCTA信号受流动的影响不显著,因此可以对高度运动的样本成像。
为证明SC-OCTA在止血情况下的效用,对新处死的小鼠大肠的浆膜表面进行了成像(图3)。这是已知的shouci使用OCT对具有内源性造影剂的非运动血液的组织进行血管造影。结果表明,OCTA在止血情况下难以分辨出任何血管,而SC-OCTA可以快速检测到几个血管(图3a)。

为证明SC-OCTA的分子敏感性,对新处死的小鼠网膜淋巴管和血管(图4a-d)以及心脏表面进行成像,并将同一心脏表面的成像图与组织学成像进行比较(图4e-g)。发现SC-OCTA能够将血管从低散射的淋巴管和脂肪细胞中区分出来。结合SC-OCAT和反向557 nm图像得到的depth-integrated SC-OCTA,其B-scan能够在三维空间显示出血管信息(图4),能够在毛细血管水平将唇粘膜脉管系统从唾液腺导管和组织中区分出来。此外depth-integrated SC-OCTA还展现出冠状动脉分支成像的能力,并能将其与邻近的淋巴管区分开来(图4e)。高分辨率和对比度还允许对淋巴管进行成像,能够轻易辨别出其中瓣膜的三尖瓣结构(图4d)。

全文小结
原创作者:北京心联光电科技有限公司







