企业档案
会员类型:初级版会员

已获得易推广信誉 等级评定
(0 -40)基础信誉积累,可浏览访问
(41-90)良好信誉积累,可接洽商谈
(91+ )优质信誉积累,可持续信赖
易推广初级版会员:3年
最后认证时间:
注册号: 【已认证】
法人代表: 【已认证】
企业类型:经销商 【已认证】
注册资金:人民币1000万 【已认证】
产品数:83
参观次数:43524
技术文章
结合OCT图像指导在异体移植模型中进行激光脑肿瘤手术
点击次数:93 发布时间:2022/5/27 11:31:54
脑肿瘤切除需要高精度的手术设备,对损伤范围控制有高的要求。美国研究人员Nitesh Katta等使用激光手术系统结合OCT图像指导,对小鼠异体移植脑肿瘤模型进行了肿瘤切除手术。此外对比激光凝固和/或消融、中、后的肿瘤区域、残余肿瘤区域以及活体区域OCT血管造影图像,结合共聚焦显微分析和组织学分析,发现OCT检测肿瘤边缘及大小结果与组织学一致,且相比于共聚焦显微技术,OCT对肿瘤深处边缘的观测范围更大,可达约250μm。证实了该OCT图像指导下的jingque无血肿瘤切除的方法的可用性。研究成果以“Laser brain cancer surgery in a xenograft model guided by opticalcoherence tomography”为题发表于Theranostics。
研究背景
在颅内肿瘤切除过程中,鉴于脑结构的精密性,需要能提供亚毫米成像和切割的外科工具和程序。目外科手术中存在非特异性损伤范围相对较大,以及缺乏术中微米分辨率的深度分辨图像引导等问题,而光学断层成像(optical tomographic imaging)和光纤激光技术(fiber laser technology)设备能够解决成像和切割限制,改善手术方法和精度。
光学相干断层扫描(OCT)根据组织的固有光学散射特性实现可视化,组织穿透深度为2 mm,分辨率可达5-10 μm。Swept-source OCT系统结合GPU数据处理,能够在几钟内显示断层图像(10-20 mm3),可提供准实时术中成像。除标准的结构图像外,通过记录组织散射随时间的变化,OCT还能显示高分辨率和高对比度的血管造影图像,而无需外源性造影剂。此外,有研究通过表征光学衰减、纹理或双折射,使用OCT且在无外源造影剂的情况下,成功对切除的人脑癌标本以及活体异种移植小鼠模型中的肿瘤边缘进行了成像。传统术中成像平台如磁共振成像(MRI)和X射线CT,分辨率有限且图像采集时间长,无法观察到在肿瘤切除期间发生的组织形状和位置的微小变化。OCT的高速血管造影和肿瘤边缘检测能力,使其成为术中指导的主要候选成像方式,而较高的空间分辨率和较快的成像速度,可以在肿瘤切除过程中为医生提供详细的逐时断层图像。
传统外科手术中,依靠电灼术的凝血和止血方法经常会造成几毫米大的附带损伤区。基于激光的外科手术方法大改善了肿瘤消融和血管凝固技术的jingque度。Tm激光在组织中的吸收深度(125 μm)可以凝结大多数鼠脑血管,同时非特异性热损伤边缘紧密。Er:YAG激光辐射的发射波长(2.94 μm)与水吸收的峰值一致,所以在肿瘤消融中能量效率高且空间上不会扩散。然而Er:YAG激光一般不用于外科手术(皮肤美容表面重修除外),在脑微循环凝固中也不作为备选方法。
已有研究介绍了图像指导的激光手术概念,成功在小鼠模型中将OCT反馈与激光凝固结合,在离体猪脑组织中结合OCT反馈来指导组织样本消融。因此本研究将OCT图像指导与Tm激光血管凝固和Er:YAG激光脑肿瘤消融相结合,通过使用小鼠肿瘤移植模型探究该双激光方法在体内脑微循环jingque消融和凝固中的适用性。

结果与讨论
图2A为距皮层250 μm荧光共聚焦显微图像的zuida强度Z-投影,展示了脉管系统(绿色)和肿瘤区域(红色)。OCT血管造影的MIP显示了肿瘤(绿色)和脉管系统(红色)区域(图2B),其中蓝色框内为低衰减系数的区域,该区域被认为是肿瘤。
OCT血管造影中的血管特征与共聚焦荧光显微图像结果大致相匹配,而OCT图像中展示的肿瘤区域(绿色),较共聚焦荧光显微图像中显示的肿瘤区域(红色)大。经组织学证实在0.3 - 1.5 mm深度间观察到大量肿瘤块,因此以共聚焦荧光显微术的成像深度(250 μm),并不能wanquan看到。图2C为小鼠皮质表面以下0.55 mm处,5 μm厚的横向组织切片(H&E染色),显示了一个细胞核密度较高的区域,表明是肿瘤。根据组织学估计,该深度的肿瘤宽度为0.81 ± 0.2 mm,OCT测定宽度为0.75 ± 0.1 mm,与组织学结果一致。此外根据组织学估计肿瘤延伸至1.15 ± 0.2 mm深度,OCT测量深度为1.30 ± 0.1 mm。另一只小鼠的荧光血管造影和OCT血管造影结果对比类似(图2D和E)。图2F为E中水平虚线位置的B-scan图像,蓝色为肿瘤区域,OCT图像中可观察到完整的肿瘤深度,但荧光共聚焦显微图像没有观察到。
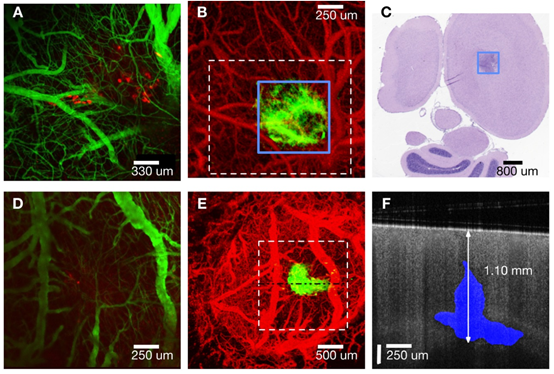
图2 A. 共聚焦荧光显微Z-projection(距皮层表面 250 μm),可见表达RFP的肿瘤细胞(红色)和脉管系统(绿色)。B. OCT血管造影(红色)、肿瘤Z-projection(绿色,距皮质表面2 mm)。C.距皮质表面550μm处的组织学横切面切片。D.共聚焦荧光显微术Z-projection(距皮质表面250 μm)。E. OCT血管造影(红色)、肿瘤Z-projection(绿色,距皮质表面2 mm)。F.肿瘤区域(蓝色)的B-scan(E中水平虚线处)。
02-OCT图像指导下的jingque凝血
对小鼠异体移植脑肿瘤进行成像(图2E),并激光凝固脉管系统(图3)。MIP图像红色圆圈为凝固的目标脉管系统区域(图3A)。激光凝固后,血管造影图像显示目标区域血流停止(图3B)。计算后发现止血深度可达约500 μm(图3C)。对比激光凝固后血管造影间的差异,发现凝固区域形状呈圆锥形并指向组织,锥顶角与入射Tm光束的数值孔径(26度)相匹配。
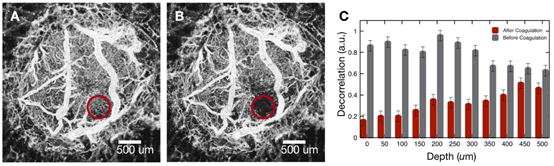
图3 A. 激光凝固OCT血管造影图。B.激光凝固后OCT血管造影图。C.激光凝固(灰色)、后(红色),标记区域深度的去相关值。
03-OCT指导下的jingque激光消融
将目标肿瘤切除一部分,使用OCT确定残余肿瘤大小,并将其与组织学测定结果进行比较,来估计治疗期间OCT的边缘检测能力。
图4A为处理的脉管系统(红色)和肿瘤区域(绿色),使用衰减系数阈值处理过的三维渲染图(图4B,衰减系数小于5.7 mm-1)指导消融手术。在所有成像的小鼠(5/5)中,都观察到肿瘤在针迹中呈细长状(图4B单星号),并沿胼胝体/海马体变宽(双星号)。Tm激光使所有滋养肿瘤的表面血管都凝固(图4C)。血管造影证实血流停止后,直接在针迹上方和中心重复进行一系列Er:YAG激光消融、成像和Z-translation步骤。试验发现,不出血移除一层组织(约125 μm)需输送约七组Er:YAG激光脉冲(1 Hz重复频率)。偶尔在新形成的消融坑底部会形成一个小凝块,但这个凝块从未发生破裂,而且切割也不流血。对比观察手术后的OCT图像,观察到切割后的残余损伤(图4D),表现为一圈凸起的组织,围绕烧蚀坑边缘而逐渐衰减(图4E,B-scan穿过烧蚀坑中心)。目视检查发现烧蚀坑周围有一圈凸起的边缘区域,且有干燥和轻度碳化的组织。随着烧蚀区域加深,凸起的干燥边缘的宽度增加。组织学图像(图4F)中缺少残余热损伤(图4D中黄色)和烧蚀坑边缘的凸起表面区域(图4E),很可能是由于结构脆弱而在组织学加工过程中无意脱落了。组织表面附近的干燥区域产生阴影伪像(图4E)。在阴影中观察到圆锥形,认为这是活体组织和受损组织之间的界面(图4E,红色虚线)。OCT测得残余损伤区内的烧蚀坑直径为940 ± 100 μm,活体区内的烧蚀直径为1940 ± 200 μm。组织学测量的烧蚀直径为1890 ± 200 μm(图F)。未消融的肿瘤区域(图E,蓝色)在组织学切片中也显示为核密度增加的区域(图F,深紫色)。OCT测量未消融肿瘤区域的深度为840 ± 100 μm,宽度为830 ± 100 μm,与组织学确定值(深度890 ± 100 μm,宽度650 ± 100 μm)相当。
图4 A. 术的OCT图像(距皮质表面2.5 mm),显示出脉管系统(红色)和肿瘤(绿色)。B.三维渲染体积式OCT视图。C.血管凝固后图像。D.激光消融后图像。E.叠加了消融肿瘤边缘(蓝色)的消融后B-scan(灰色)。F. E中B-scan区域的HE染色切片。
小结
参考文献:Katta, N , et al. "Laser brain cancer surgery in a xenograft model guided by optical coherence tomography." Theranostics 9.12(2019):3555.
原创作者:北京心联光电科技有限公司







