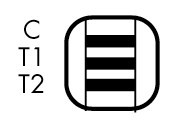产品展示
疟疾快速检测卡-疟疾快速检测卡价格
点击次数:193发布时间:2014/1/2 15:37:21

更新日期:2014/1/2 15:37:21
所 在 地:中国大陆
产品型号:
优质供应
详细内容
疟疾快速诊断试剂卡说明书
【产品名称】
通用名称:疟原虫抗原检测试剂盒(胶体金法)
英文名称:BinaxNOW Malaria Test
销售服务热线:13570344479
【包装规格】25人份/盒。
该试剂拥有美国FDA认证、欧洲CE认证、中国进口医疗器械证,是全球*受欢迎的疟疾诊断试剂。
此外广州健仑生物科技有公司是著名的诊断试剂供应,健仑生物长期为中国石化集团、中国石油集团、中国有色金属集团、联合国驻苏丹维和部队、联合国驻刚果金维和部队等十多大型跨国集团公司在非洲地区工作人员提供疟疾体检试剂卡。

【预期用途】
疟原虫抗原检测试剂盒(胶体金法)是体外免疫层析试验,用于定性检测具有疟疾症状和体征人群EDTA抗凝静脉血或毛细血管血中的恶性疟原虫抗原和间日疟原虫抗原,可对恶性疟原虫、间日疟原虫做出辅助诊断,并可对恶性疟原虫和间日疟原虫做出鉴别诊断。
该试验不用于无症状人群的筛查。
【检验原理】
疟原虫抗原检测试剂盒(胶体金法)使用的是薄膜免疫层析技术,该技术用单克隆抗体检测静脉血和末梢血中的恶性疟原虫抗原和间日疟原虫抗原,这两种抗体与对照抗体固定到膜支持物上形成三条不同的线,膜支持物与样品垫相连,结合有可视粒子的对照抗体和抗疟原虫抗体浸渗在样品垫上,组成检测条。检测条位于一块书形铰链状的检测卡中,与冲洗垫和吸收垫一道参与检测板闭合后薄膜的清洗。
检测时,将全血加到样品垫上,标本中存在的疟原虫抗原与抗疟原虫抗体结合物结合。将A试剂液加到检测条的底部,使抗原结合物复合物沿检测条流动,在固定抗体处被捕获,形成检测线,固定的对照抗体捕获对照结合物,形成对照线。一旦血标本流过检测条,就将检测板闭合,使加到冲洗垫中的A试剂把检测条上多余的血液冲去。
检验结果可用紫红色线的存在与否来解释。15分钟读数时,阳性结果将包括一条检测线(或两条检测线)和一条对照线,阴性结果只产生一条对照线,阴性表明标本中未检出疟原虫抗原。如果不出现对照线,不管检测线出现与否,结果都为无效。
【主要组成成份】
1. 检测卡
| 检测卡 | 组分 |
| 捕获线(T1)抗体 | HRPⅡ捕获抗体 |
| 捕获线(T1)结合物 | 金标记的抗HRPⅡ抗体 |
| 捕获线(T2)抗体 | 抗醛缩酶IgG |
| 捕获线(T2)结合物 | 金标记的抗醛缩酶 |
| 质控线捕获抗体 | 鸡IgY |
| 质控线结合物 | 结合金颗粒的驴抗鸡IgY |
2.A试剂:含去污剂和叠氮钠的Tris缓冲液。
3.毛细管:EDTA抗凝毛细管,用于将末梢全血加入到检测卡中。
自备材料
采血针、灭菌拭子或棉球、时钟、秒表或跑表
注:加样时,要使用能加样15μl体积的经过校准的加样器
【储存条件及有效期】
试剂盒在2-37℃贮藏。
试剂有效期为自生产之日起24个月。
试剂在满足贮藏条件的情况下可稳定使用至效期(效期标注在外包装和试剂盒内)结束。
【样本要求】
EDTA抗凝的新鲜全血。手指血要立即测试,静脉血可于2-30℃保存3天,但测试前须平衡至室温(15-30℃),并彻底混匀。
疟疾快速检测卡【检验方法】
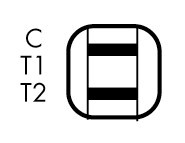
疟疾快速检测卡【检验结果的解释】
疟疾快速检测卡有效试验结果
对照线(C)会出现在所有有效试验中,当存在对照线时,试验结果可如下解释。注:出现的任意检测线,即使颜色非常浅淡,也解释为阳性结果。
| 试验 | 结果 | 种类 / 解释 |
| T1 阳性 | 恶性疟原虫(P.f.) | |
| T2 阳性 |
| 间日疟原虫(P.v.) |
| T1 + T2 阳性 |
| 恶性疟原虫结果阳性 (P.f.),在有些病例同时出现T1线和T2线可能表明存在恶性疟原虫和间日疟原虫的混合感染。 |
| 无T1 和T2线 |
| 阴性结果 (未检测到疟原虫抗原) |
无效和/或无法解释的试验结果
如果对照线不出现,不管检测线出现与否结果都是无效的。
15分钟时,如果背景色妨碍读数,结果无法解释。标本或A试剂的加入方法不正确可导致试验无效或试验结果无法解释。用新检测板重新检测前,请查阅检测步骤部分和预防措施#5。如果问题仍无法解决,请与技术部门联系。
【产品性能指标】
预期值
疟疾是一种严重的寄生虫病,是热带亚热带地区危害健康的主要因素。疟原虫的阳性检出率受多种因素影响,包括标本采集方法、检验手段、地理位置和疾病在特定区域的流行性。恶性疟原虫感染被认为是*凶险的,而间日疟原虫很少有致命性。
2001年,在疟疾地方流行区域进行了一项临床研究。在有症状病人中,恶性疟疾(用显微镜检查进行了确定)平均占14%,间日疟疾平均占29%,恶性疟与间日疟的混合感染占的比例非常低。
2005-2006年在美国东部进行了一项多层研究,从发热和有发热史的住院和门诊病人(这些病人住在很少发生疟疾的地区,被看作是疟原虫阴性病人)中收集了217份全血标本,用BinaxNOW®疟原虫抗原检测试剂盒进行检测,结果216(99.5%)人阴性。
操作特性
临床标本特性-BinaxNOW®疟原虫抗原检测试剂盒敏感性和特异性-地方流行人群:
2001年在美国国外疟原虫流行地区进行了一个多中心前瞻性研究,研究中将BinaxNOW®疟原虫抗原检测试剂盒与吉姆萨染色显微镜技术进行了比较。从带有疟原虫样症状的病人中采集了4,122份全血标本用BinaxNOW®疟原虫抗原检测试剂盒评价。由于疟原虫的无性形式(非配子体)表示有感染,因此,显微镜检查只有检查到疟原虫的无性形式才能视为阳性。
测试人群中44%的人(1,796/4,122)用显微镜检查为疟疾阳性,其中有557个病人为恶性疟、1,187个人为间日疟,34个人为恶性疟/间日疟混合感染。59%的人为男性,41%的人为女性。19%的人为儿童(<18岁),81%的人为成人(>18岁)。BinaxNOW®疟原虫抗原检测试剂盒对单种疟原虫和恶性疟/间日疟混合感染的性能概述如下。
BinaNOW®疟原虫抗原检测试剂盒的试验性能在病人的年龄和性别方面没有差异,BinaxNOW®疟原虫抗原检测试剂盒对恶性疟的特异性在5%接受过抗疟药物治疗的病人中(89.4%)较之未治疗的病人(94.4%)有少许下降,但无统计学差异。
在整个研究人群中,BinaxNOW®疟原虫抗原检测试剂盒对低红细胞压积和高红细胞压积样本的试验性能是等同的。
对恶性疟原虫感染的检测
BinaxNOW®疟原虫抗原检测试剂盒和显微镜检查对恶性疟原虫的敏感性和特异性情况如下所示。对敏感性的评价基于显微镜检查中观察到的寄生物血症水平(每微升的寄生虫量)。
BinaxNOW®疟原虫抗原检测试剂盒与显微镜检查在恶性疟原虫敏感性和特异性方面的比较
恶性疟的敏感性
| 寄生物血症水平 | 敏感性% | 95%可信区间 |
| >5000 | 99.7%(326/327) | 98-100% |
| 1000-5000 | 99.2%(126/127) | 96—100% |
| 500-1000 | 92.6%(25/27) | 76—99% |
| 100-500 | 89.2%(33/37) | 75—97% |
| 0-100 | 53.9%(21/39) | 37—70% |
| 总计 | 95.3%(531/557) | 93—97% |
恶性疟的特异性
| 特异性% | 95%可信区间 |
| 94.2%(3297/3500) | 93—95% |
间日疟原虫感染的检测
BinaxNOW®疟原虫抗原检测试剂盒和显微镜检查对间日疟原虫的敏感性和特异性情况如下所示。对敏感性的评价基于显微镜检查中观察到的寄生物血症水平(每微升的寄生虫量)。有68份标本显微镜检查仅间日疟原虫阳性,用BinaxNOW®疟原虫抗原检测试剂盒检查却出现了两条检测线。如果这些结果也记录在阳性之列,BinaxNOW®疟原虫抗原检测试剂盒对间日疟原虫测定的总敏感性从68.9%提高到74.6%(886/1,187)。
与显微镜法相比,BinaxNOW®疟原虫抗原检测试剂盒对间日疟原虫的敏感性和特异性
对间日疟原虫的敏感性
| 寄生物血症水平 | 敏感性% | 95%可信区间 |
| >5000 | 93.5%(462/494) | 91-96% |
| 1000-5000 | 81.0%(277/342) | 76—85% |
| 500-1000 | 47.4%(37/78) | 36—59% |
| 100-500 | 23.6%(34/144) | 17—31% |
| 0-100 | 6.2%(8/129) | 3—12% |
| 总计 | 68.9%(818/1187) | 66—72% |
对间日疟原虫的特异性
| 特异性% | 95%可信区间 |
| 99.8%(2863/2870) | 99—100% |
恶性疟和间日疟的检测限:
在上述研究中,经确定BinaxNOW®疟原虫抗原检测试剂盒对恶性疟的临床检测限(LOD)(定义为95%的检测次数产生阳性结果的寄生虫血症水平)为1001-1500个寄生虫/微升,对间日疟的检出限为5001-5500个寄生虫/微升。
样品的临床性能-BinaxNOW®疟原虫抗原检测试剂盒在流行人群中对指血和静脉血的敏感性和特异性:
2003年在美国国外疟疾流行区域进行了一项前瞻性研究,该研究用静脉血和指血对BinaxNOW®疟原虫抗原检测试剂盒的性能与吉姆萨显微镜法进行了比较。BinaxNOW®疟原虫抗原检测试剂盒评估的全血采自787位有疟疾症状的病人的静脉和指尖。由于无性体(非配子体)表示有感染,显微镜检查只有查到无性体方可视为阳性。
用BinaxNOW®疟原虫抗原检测试剂盒和显微镜法对782份静脉血标本和784份指尖血标本进行分析,BinaxNOW®疟原虫抗原检测试剂盒相对显微镜法对恶性疟和间日疟的敏感性和特异性如下:
与显微镜法相比,BinaxNOW®疟原虫抗原检测试剂盒对静脉血和指尖血中恶性疟和间日疟的敏感性和特异性
| 静脉血标本 | ||||
| 敏感性% | 95%可信区间 | 特异性% | 95%可信区间 | |
| 恶性疟 | 100%(81/81) | 96-100% | 94.7%(664/701) | 93-96% |
| 间日疟 | 81.6%(102/125) | 74-87% | 99.7%(655/657) | 99-100% |
【注意事项】
1. 用于体外诊断。
2. 检测前将检测卡密封保存。
3. 不要使用超过有效期的试剂盒。
4. 不要将不同批号试剂混合使用。
5. 为了取得*佳标本流量,优化试验过程,加标本和A试剂时要照试验步骤操作。向检测卡上加A试剂时要注意下列问题:
a. 将A试剂瓶垂直置于检测卡垫的上方1至2.5厘米处,慢速自由滴入试剂,以使加到冲洗垫和吸收垫上的试剂量合乎需要。
b. 在将A试剂加到紫色标本垫正下方的白色垫上时,需待滴试剂完全被垫吸收后方可加第二滴,必要时可加入第三滴-见操作步骤3。
6. 如果用的是静脉血,要轻扣试管或小瓶将标本混匀。吸样前,将标本在加样头中来回吸排几次。
7. 如果用的是末梢血,要使用试剂盒中提供的微量毛细管加样。
8. 病人标本和检测卡要视为传染性物质,按血液传染源的预防措施处理,不要再次开封和使用检测卡。
9. 空气循环过度(即:空调、风扇等)可减慢标本的流速,建议不要在流速过大的环境中测试标本。
10. 解释结果时,使用明亮未过滤的光源。
11. 所有毛细管和吸头都是一次性的,不要多份标本合用。加样设备、容器或试剂的污染可导致结果不准确。
12. A试剂用叠氮钠做防腐剂,叠氮钠有毒,应小心处理,不要误吸或与皮肤接触。它可与铅或铜反应形成爆炸性的金属氮化物。接触后要用大量清水冲洗。
【参考方献】
1. Breman, J.G., M.S. Alilio, and A. Mills. Conquering the intolerable burden of malaria: what’s new, what’s needed: a summary. American J. of Tropical Medicine and Hygiene, 2004; 71 (Suppl 2) 1-15.
2. Center for Disease (CDC). Treatment of Malaria (Guidelines for Clinicians), June 28, 2004.
3. Manual of Clinical Microbiology. 8th Endition,2003 “Plasmodium and Babesia”. pp. 1944-59.
4. Tjitra, Emiliana, S. Suprianto, J. McBroom, B.J. Currie, and N.M.Anstey. Persistent ICT Malaria P.f./P.v. Panmalarial and HRP2 Antigen Reactivity after Treatment of Plasmodium falciparum Malaria Is Associated with Gametocytemia and Results in False-Positive Diagnoses of Plasmodium vivax in Convalescene. J. of Clinical Microbiology, March 2001; 39: 1025-1031.
5. Moody. Anthony. Rapid Diagnostic Tests for Malaria Parasites. Clinical microbiology Reviews, Jan. 2002; 15:66-78.
6. Lqbal, J., A. Sher, and A.Rab. Plasmodium falciparum Histidine-Rich Protein 2-Based Immunocapture Diagnostic Assay for Malaria: Cross-Reactivity with Rheumatoid Factors.J. of clinical Microbiology, March 2000;38: 1184-1186.
7. Review Criteria for Assessment of Rheumatoid Factor (Rf) in vitro Diagnostic Devices Using Enzyme-Linked Immunoassay(EIA), Enzyme Linked Immunosorbent Assay (ELISA), Particle Agglutination Tests, and Laser and Rate Nephelometry, FDA Guidance Document; February 21,1997.
8. Lysenko, A. JA. And A. E. Beljaev. An Analysis of the Geographical Distribution of Plasmodium ovale. World Health Organization Bulletin, 1969; 40:383-394.
9. Collins, W.E., and G. M. Jeffery. Plasmodium ovale: Parasite and Disease. Clinical Microbiology Reviews, July 2005; 18:570-581.
售后服务单位:
【公司名称】 广州健仑生物科技有限公司
【联系电话】 13570344479
【公司传真】
【电子邮件】 Simon@jianlun.com
【腾讯 QQ 】 712628583
【公司网址】 www.jianlun.com
【营销中心】 广州市中山大道中358号东溪大厦B座511室
【公司地址】 广州市天河区车陂第十五工业园一幢4067