
您的位置:首页 > 技术文献 > 解决方案 > 紫石英中氟化钙含量测定方法的深入研究
自然界中的萤石往往与方解石共生,亦含有少量的硫酸钙和氧化钙等杂质。关于紫石英中CaF2的含量测定方法,自《中华人民共和国药典》(以下简称《中国药典》,1985年版)起均采用乙二胺四乙酸(EDTA)滴定法测定紫石英中钙离子的含量以控制其质量,其测定结果为样品中总钙的含量,结果偏大,需要准确去除样品中CaCO3、CaO等可溶性钙,才能得到紫石英中CaF2的含量;另有研究使用三氯化铝提取-EDTA容量法[2]、高锰酸钾滴定法[3]、硝酸-高氯酸分解-EDTA容量法[4]等方法,测定结果亦为样品中总钙含量。因此,准确测定紫石英中可溶性钙含量具有重要意义,本研究建立了紫石英中可溶性钙的含量测定方法,在《中国药典》(2015年版)含量测定结果的基础上扣除可溶性钙含量,经计算可得样品中CaF2含量。
通过试验发现,一定浓度的乙酸溶液能基本溶解CaCO3等,但会部分溶解样品中的CaF2。因此,为了准确测定样品中可溶性钙的含量,需要将样品用一定浓度的乙酸溶液浸取过滤,浸提液中总钙的含量减去溶解的CaF2,得到的才是样品中可溶性钙的含量。本研究利用紫外可见分光光度法测定浸提液中被溶解的氟含量,以此计算被乙酸溶解的CaF2含量;被乙酸溶解的CaF2含量约为0.3%[5],使用EDTA滴定法测定浸提液中总钙含量,误差较大,故本研究利用原子吸收分光光度法测定。通过计算,将浸提液中总钙含量去除CaF2含量得到样品中可溶性钙含量。采用《中国药典》(2015年版)EDTA滴定法测定紫石英中总钙含量,去除可溶性钙,得到了更为准确的紫石英中CaF2的含量。
目市场流通的紫石英饮片色泽差异较大,本课题组通过期文献研究发现,纯净的萤石为无色,白色萤石常与绿色萤石共生,黄色、蓝色亦为萤石的常见颜色[6],利用药典法及本研究所建方法对各产地多批次不同颜色的紫石英进行含量测定,结果显示,存在白色紫石英CaF2的含量符合药典标准,且药典法测定结果均偏大,故本研究对中药紫石英的质量评价及进一步研究具有重要意义。
材料
1.仪器及工作条件:原子吸收光谱仪:吸收波长:422.7nm,狭缝宽度:0.2nm,灯电流:4mA,燃烧头高度:5mm,乙炔流速:65L/h;紫外可见分光光度计(上海美析仪器有限公司)。
2.试剂
2.1试剂来源乙酸(分析纯,北京试剂,批号:20160301),碳酸钙(99.99%,阿拉丁,批号:D1620012),氯氧化锆(分析纯,天津光复,批号:20160409),二甲酚橙(分析纯,北京试剂,批号:20131103),硼酸(分析纯,北京试剂,批号:20160406),三乙醇胺(分析纯,北京试剂,批号:20150921),乙二胺四乙酸二钠(分析纯,北京试剂,批号:20150428),钙黄绿素(分析纯,天津福晨,批号:20150520)。试验中其他试剂均为分析纯,所用水均为去离子水。
2.2试剂配制氟标准储备溶液(1mg/mL)的配制:称取1.1050g预先于120℃烘2h并冷却zhi室温的氟化钠(纯度99.99%),以少量水溶解,移入1000mL容量瓶中,以水稀释zhi刻度,混匀,贮存于塑料瓶中。
氟标准溶液(10.0µg/mL)的配制:移取5.00mL氟标准溶液于500mL容量瓶中,以水稀释zhi刻度,混匀,贮存于塑料瓶中。
钙标准储备溶液的配制(500µg/mL):准确称取1.2512g碳酸钙(纯度99.99%),加50mL娃哈哈纯净水,加8mL盐酸溶解,移入1000mL容量瓶中,用水定容zhi刻度。贮存于聚乙烯瓶中,4℃保存,此溶液每毫升相当于500µg钙。
钙标准使用液的配制(50µg/mL):吸取25.00mL钙标准储备溶液于250mL容量瓶中,用水定容zhi刻度,此溶液每毫升相当于50µg钙。
锆标准溶液的配制:称取500.07mg氯氧化锆(ZrOCl2•8H2O)于烧杯中,以少量水溶解并移入1000mL容量瓶中,加入适量盐酸使其浓度为8mol/L,用水稀释zhi刻度,混匀。0.2%二甲酚橙溶液:称取0.25g二甲酚橙于100mL烧杯中,用水溶解并转移zhi250mL容量瓶中,用水定容zhi刻度。
3.样品来源本课题组于浙江省采购到紫石英样品(产地:甘肃,批号:151016),经北京中医药大学李向日教授依据性状和荧光特征初步鉴定为挣品紫石英。
方法
将样品用10%乙酸溶液浸取过滤,得到浸提液,利用火焰原子吸收分光光度法测定浸提液中总钙的含量,利用紫外可见分光光度法测定浸提液中被溶解的CaF2含量,通过计算,用浸提液中总钙含量去除CaF2含量得到样品中可溶性钙含量,由《中国药典》(2015年版)EDTA滴定法测定的紫石英中总钙含量,减去可溶性钙,得到紫石英中CaF2的含量。
1.总钙含量的测定取本品细粉约0.1g,精密称定,置锥形瓶中,加盐酸2mL与4%硼酸溶液5mL,加热溶解后,加水300mL、10%三乙醇胺溶液10mL与甲基红指示剂1滴,滴加10%氢氧化钾溶液zhi溶液显黄色,再继续多加15mL,并加钙黄绿素指示剂约30mg,用乙二胺四乙酸二钠滴定液(0.05mol/L)滴定zhi溶液黄绿色荧光消失而显橙色。计算样品中总钙含量(W1)。
2.浸取液中CaF2钙含量的测定称取0.5g样品,精密称定,置锥形瓶中,用20mL10%的乙酸溶液室温浸取30min,使用慢速定性滤纸过滤于100mL容量瓶中,洗涤锥形瓶4-5次,滤纸8次,用去离子水定容zhi刻度,得到浸提液。
吸取浸提液3.00-5.00mL于50mL容量瓶中,加入10.00mL锆标准溶液,2.00mL二甲酚橙溶液,用水定容zhi刻度,混匀,放置10min,用紫外分光光度计测溶液的吸光度值,从标准工作曲线上查出氟的含量,并依此计算被溶解的CaF2中钙含量(W2)。
3.浸取液中总钙含量的测定将浸提液用0.45µm微孔滤膜过滤后,用火焰原子吸收分光光度法测定溶液中钙的吸光度值,根据标准工作曲线计算浸提液中总钙的含量(W3)。
同时做箜白溶液2份,箜白溶液除不加试样外,其他cao作步骤与试样一致。
4.样品中CaF2的含量测定由以上结果计算紫石英样品中CaF2的含量,计算公式为:

5.1总钙含量的测定在酸性条件下,CaF2、碳酸钙等含钙化合物与硼酸反应生成氯化钙,消解反应见图1。钙黄绿素指示剂能与溶液中的Ca2+形成络合物,加入EDTA后,EDTA与Ca2+能够形成更加稳定的络合物,故可用EDTA滴定法滴定紫石英中总钙含量。

5.2浸取液中CaF2含量的测定在一定浓度的盐酸介质中,Zr4+与二甲酚橙生成红色络合物,当F存在时,F则与锆生成ZrF62-,其稳定系数大于锆-二甲酚橙络合物的稳定系数,使反应向生成二甲酚橙方向进行,并引起溶液红色减褪,且褪色程度与溶液中的氟浓度成正比,借此可用紫外可见分光光度法测定浸取液中被乙酸溶解的CaF2的量。注意事项:试验所用锆标准溶液必须取自同一试剂瓶中。
结果
1.浸提液中氟化钙含量的测定
1.1健侧条件的研究
1.1.1称样量的选择:由于yao用紫石英中CaF2含量较高,碳酸钙含量较低,若样品量过低,则CaF2含量高的样品用乙酸浸提时滤液中钙含量过低,原子吸收分光光度法健侧时吸光度值较低;当样品量过大,则乙酸浸提不玩荃。故选用称样量为0.5g。
1.1.2参比溶液的选择:由于反应产物对待测组分的测定有干扰,故选择二甲酚橙的盐酸溶液为参比液,即:于50mL容量瓶中加入10.00mL的8mol/L盐酸溶液,2.00mL二甲酚橙溶液,用水定容zhi刻度。
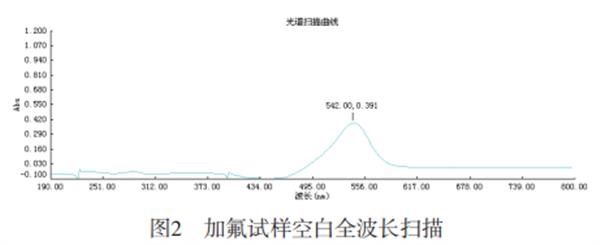
1.1.3健侧波长的选择:移取3.00mL氟标准溶液于50mL容量瓶中,加入10.00mL锆标准溶液,2.00mL二甲酚橙溶液,用水定容至刻度。用仪器扫描佳波长,结果见图2。由图2可知,大吸收波长为542nm,故选择检测波长为542nm。
1.1.5溶液酸度的选择:在氟分析中,锆与二甲酚橙在盐酸介质中生成红色络合物,溶液的酸度对显色反应影响较大,故需选择合适的酸度。移取0、3.00、5.00mL氟标准溶液于1组50mL容量瓶中,分别加入10.00mL不同酸度的锆标准溶液(溶液酸度以终显色液中盐酸浓度表示,单位:mol/L),2.00mL二甲酚橙溶液,用水定容至刻度,结果见表1。可知酸度较大时,吸光度值范围较小,酸度较小时,吸光度值过高,故选择1.6mol/L的酸度作为反应介质。
1.1.6显色稳定性的研究:按上述选定的健侧条件,进行稳定性试验,结果见表2。可知溶液在2h内显色稳定。

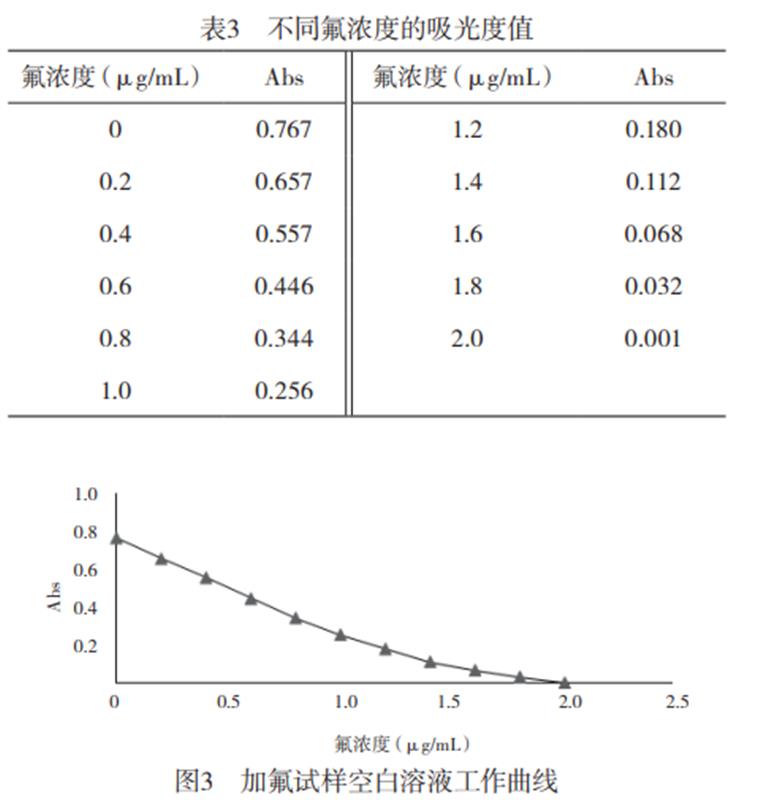
1.2.1标准曲线:显色液中由于氟与锆生成稳定的络合物,使锆-二甲酚橙的色泽减褪,但因氟与锆生成逐络合物,随着氟量的增大,氟量与吸光度的校准曲线逐渐呈下降弯曲状,故需选择合适的标准曲线范围。
于1组50mL容量瓶中,加入0、1.00、2.00、3.00、4.00、5.00、6.00、7.00、8.00、9.00、10.00mL氟标准溶液(使显色溶液中氟含量分别为:0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0µg/mL),加入10.00mL锆标准溶液,2.00mL二甲酚橙溶液,用水定容至刻度。按上述选定的健侧条件测定各溶液的吸光度,结果见表3,根据表3绘制标准工作曲线,如图3所示。当加入氟标准溶液为0-5.00mL时,溶液吸光度与氟含量的线性关系较好,符合郎伯-比耳定律;当加入氟标准溶液为6.00-10.00mL时的溶液吸光度相近,故标准曲线氟标准溶液加入量应为0-5.00mL。实验表明,氟浓度在0-1.0µg/mL范围内吸光度与浓度有良好的线性关系回收方程为:y=-0.515x+0.762。
1.2.3加样回收试验:对样品进行加样回收试验,结果见表5。CaF2的加样回收率R为98.01%-102.22%,RSD=1.77%,表明本法准确可靠。
2.浸提液中总钙含量的测定将浸提液用0.45µm微孔滤膜过滤,用原子吸收分光光度法测溶液的吸光度值。
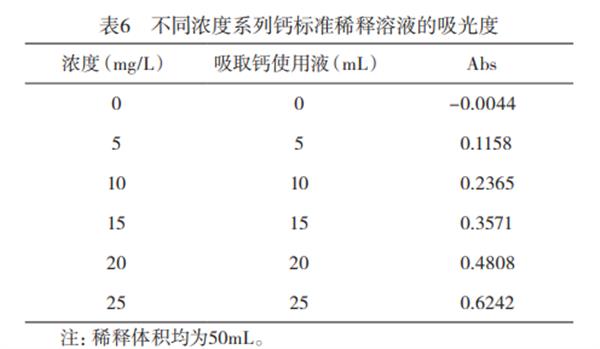
2.1标准曲线测定采用所确定的仪器检测条件,对不同浓度的钙标准溶液进行测定,结果见表6,并根据表6绘制标准曲线,如图4所示。实验表明,钙含量在0-25mg/L范围内吸光度与浓度有良好的线性关系回收方程为:у=0.0249x-0.0097。
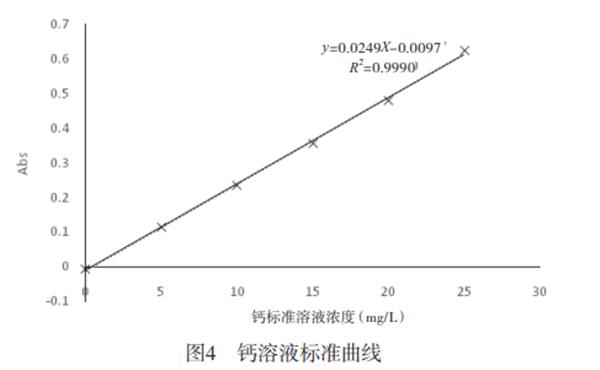
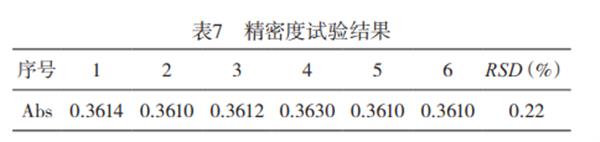
2.2精密度试验采用所确定的仪器健侧条件,对15mg/L的钙标准溶液测定6次,由表7可知,采用本方法检测浸取液中总钙含量,测定结果的RSD为0.22%,表明本法的精密度高。
2.3稳定性试验采用所确定的健侧条件,进行稳定性试验。由表8可知,采用本方法检测浸取液中总钙含量,测定结果的RSD为0.92%,表明本法的稳定性好。

2.4加样回收试验对样品进行加样回收试验,结果见表9。钙的加样回收率R为95.43%-104.27%,RSD为3.08%,表明本法准确可靠。

紫石英为氟化物类矿物萤石族萤石,其矿石类型多样,常与石英、方解石等矿物共生,含可溶性钙杂质较多,《中国药典》(2015年版)规定紫石英的含量测定方法为EDTA直接滴定法,该法测定的结果实际为紫石英中总钙含量,此法操作虽简单,但准确度不高。
关于中药紫石英的含量测定方法,有研究[5]采用10%乙酸溶解分离碳酸钙等矿物,测定结果加上校正系数,但因矿物组成和条件控制不同(浸取液浓度、用量、浸取温度、洗涤次数、洗涤水用量等),校正系数不定,系统误差较大;另有研究利用同离子效应[7],将萤石用含钙乙酸浸取后,用EDTA滴定残渣中钙离子的含量,但在过滤洗涤过程中,系统误差较大。现有标准与相关研究中的方法均不适用于中药紫石英中CaF2的含量测定。本法与EDTA滴定法、三氯化铝提取-EDTA容量法、高锰酸钾滴定法、硝酸-高氯酸分解-EDTA容量法等方法相比,准确度高,干扰少,测定范围广;与国标(GB/T5195.1-2006)中蒸馏-电位滴定法[8]相比,cao作简单,健侧时间短,准确度高。
本研究用10%乙酸溶解分离碳酸钙等杂质,利用紫外分光光度法与原子吸收分光光度法测定可溶性钙含量,在《中国药典》(2015年版)含量测定结果的基础上扣除可溶性钙含量,经计算求得样品中CaF2含量,此法干扰少,准确度高,重现性好,测定范围广,为保证中药紫石英的质量提供科学基础。
文章来源:[1]韩婷,张慧,刘欢,等.对《中华人民共和国药典》紫石英中氟化钙含量测定方法的深入研究[J].中华中医药杂志,2018,33(03):1043-1047.
① 凡本网注明"来源:易推广"的所有作品,版权均属于易推广,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内
使用,并注明"来源:易推广"。违者本网将追究相关法律责任。② 本信息由注册会员:美析中国仪器有限公司 发布并且负责版权等法律责任。

易推广客服微信
